Puntos clave
|
Introducción
La psoriasis es una enfermedad inflamatoria crónica común de la piel, que también se describe como un trastorno inflamatorio multisistémico asociado a múltiples comorbilidades. Las personas con psoriasis tienen mayor riesgo de presentar artritis psoriásica y otras enfermedades, tales como obesidad, síndrome metabólico, hipertensión, diabetes y enfermedad ateroesclerótica1.
En adultos, la prevalencia de la psoriasis se sitúa hasta en un 11,4 % de la población, mientras que puede afectar hasta a un 1,4 % de los niños cuanto más nos alejamos del Ecuador. La enfermedad se presenta en hombres y mujeres en igual medida y a cualquier edad; sin embargo, su incidencia es mayor en la cuarta y sexta décadas de la vida1.
En la psoriasis intervienen mecanismos inmunitarios complejos, determinados predominantemente por factores genéticos. El locus de susceptibilidad a la psoriasis (PSORS1) dentro del complejo mayor de histocompatibilidad en el cromosoma 6p21 se considera un determinante genético importante de esta enfermedad. Asimismo, factores de riesgo ambientales y metabólicos como la ganancia de peso, el tabaquismo, el consumo de alcohol elevado y el estrés juegan un rol conocido1–3.
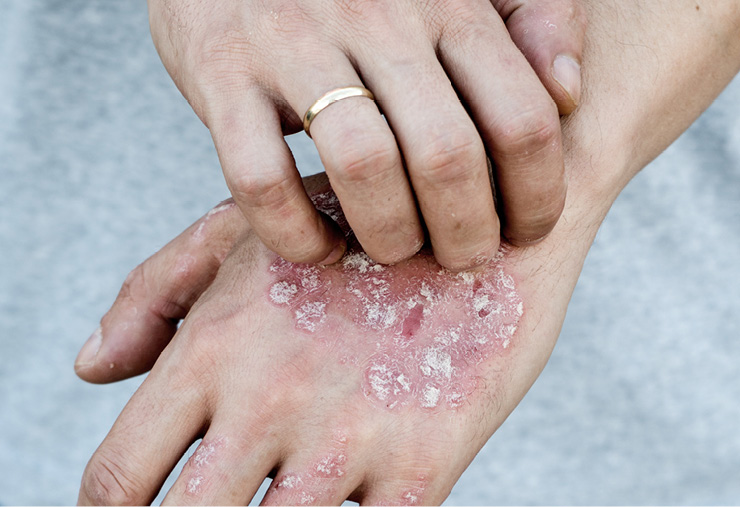
Entre los subtipos clínicos más comunes de la psoriasis encontramos la psoriasis crónica en placas, que se caracteriza por lesiones eritematosas bien definidas cubiertas por escamas gruesas, a menudo localizadas en el cuero cabelludo, la parte posterior del codo, las rodillas y la hendidura interglútea. Otros subtipos importantes de la enfermedad son la psoriasis guttata, la psoriasis pustulosa y la psoriasis eritrodérmica1.
La interacción entre el sistema inmunitario innato y el adaptativo es clave en la fisiopatología de la psoriasis. En concreto, la producción de las interleucinas (IL) 23 e IL-17 y la consecuente activación de los linfocitos T cooperadores de tipo 17 (Th17) contribuyen a alimentar y mantener la respuesta inflamatoria característica de la enfermedad. Además, las células dendríticas, los macrófagos y los linfocitos T producen el factor de necrosis tumoral α (TNF-α), lo que induce la producción de otras citocinas proinflamatorias y amplifica la respuesta4.
La psoriasis crónica en placas puede representar hasta el 79 % y el 74 % de todas las formas de psoriasis en adultos y niños con la enfermedad, respectivamente5. Si bien estas lesiones pueden ser asintomáticas, el prurito es un síntoma común. En pacientes con psoriasis, se ha descrito una prevalencia de prurito entre un 60 % y un 90 % de los pacientes, con una intensidad media de 5,2 a 6,4 puntos en la escala analógica visual de prurito (EVA, 0-10)6–9.
El objetivo de esta revisión es explorar las guías de práctica clínica, revisiones sistemáticas de la literatura y documentos de consenso de sociedades científicas líderes en psoriasis, que puedan dar respuesta a las siguientes preguntas:
- ¿Qué herramientas son las más aceptadas para la evaluación del prurito y la calidad de vida en adultos con psoriasis?
- En adultos con esta enfermedad, ¿cuáles son los tratamientos más eficaces para el manejo del prurito?
Evaluación del prurito y la calidad de vida
El prurito es un síntoma importante de la psoriasis, que a menudo no se reconoce. Se recomienda evaluar la gravedad del picor en pacientes con la enfermedad, por su impacto en la calidad de vida (QoL, por su sigla en inglés)10.
La eficacia del tratamiento de la psoriasis suele evaluarse mediante la escala Psoriasis Area and Severity Index (PASI), siendo también importante considerar su efecto sobre la resolución del prurito, ya que es el síntoma más molesto para los pacientes y porque no existe un tratamiento antipruriginoso específico para tratar el picor en la psoriasis9,11,12.
En varios estudios publicados no se ha encontrado una correlación entre la puntuación obtenida con el índice PASI y la intensidad del prurito en pacientes con psoriasis, aunque persisten discrepancias en este sentido9,13–18. Así, según Théréné et al., los efectos del tratamiento de la psoriasis sobre el picor no deben evaluarse en estricta consonancia con los efectos del tratamiento sobre la escala PASI9.
Según la AAD, existen varias herramientas para evaluar el prurito; sin embargo, las guías de práctica clínica de esta sociedad no emiten ninguna recomendación sobre cuál utilizar, por limitaciones de la evidencia al respecto. Tanto la EVA como la numeric rating scale (NRS) son los instrumentos de evaluación del prurito más utilizados. Se considera que existe una diferencia mínima clínicamente importante cuando se observa un cambio de 3 a 4 puntos en cualquiera de estas dos escalas10.
El prurito es un síntoma importante de la psoriasis. Se recomienda una evaluación apropiada de la gravedad del picor cuando este está presente10.
A diferencia de la ausencia de relación entre el prurito y el índice de gravedad de la psoriasis PASI, en algunos estudios se ha encontrado asociación entre una mejoría del picor y las puntuaciones de QoL, medidas mediante las escalas Dermatology Life Quality Index (DLQI) y el cuestionario SF-369,13,19–21. Asimismo, en otro estudio se ha observado una correlación significativa entre los índices PASI y DLQI con las puntuaciones de picor9,22.
Para evaluar la QoL en la psoriasis, la JDA, además de mediante la escala DLQI (empleada para las enfermedades dermatológicas en general), recomienda valorar al paciente mediante el Psoriasis Disability Index, por su especificidad para la psoriasis y su utilidad para evaluar la QoL23.
Por su parte, el Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPs) aconseja incluir una escala analógica visual para valorar el prurito y la satisfacción del paciente con el tratamiento, en la evaluación del impacto en la calidad de vida del tratamiento para la psoriasis24.
Tratamiento tópico del prurito
Los humectantes ―como cremas, pomadas, lociones y geles― pueden emplearse dentro del tratamiento general de los pacientes con psoriasis para ayudar a reducir el picor y la descamación. Un ensayo clínico controlado mostró que la combinación de mometasona y emoliente mejoró los síntomas y la descamación de la piel en la zona palmoplantar después de cuatro semanas de tratamiento, en comparación con mometasona sola10,25.
El empleo de un emoliente en combinación con un corticosteroide tópico durante 4 a 8 semanas puede utilizarse para ayudar a reducir el picor, la descamación y el porcentaje de superficie corporal afectada, así como para prevenir la recaída rápida de la psoriasis cuando se interrumpe el tratamiento con los corticosteroides tópicos10.
Tratamientos sistémicos biológicos y no biológicos en el manejo del prurito
En una revisión sistemática de la literatura, que incluyó 35 estudios en los que se evaluó el efecto de diferentes tratamientos sistémicos para la psoriasis sobre el picor, se metanalizaron 13 de los ensayos frente a placebo, observándose que el grupo de los anti-IL-17 tuvieron la mayor magnitud en la reducción del picor, con −4,52 puntos; les siguieron los inhibidores de JAK (baricitinib y tofacitinib, −3,56 puntos); los inhibidores del factor de necrosis tumoral α (−3,34 puntos) y el apremilast (−2,18 puntos). La escala de valoración del picor utilizada en los metanálisis fue la ISS (Itch Severity Scale). Aunque este metanálisis proporciona una estimación cuantitativa del efecto terapéutico, no permite concluir de forma precisa una supuesta jerarquía entre los tratamientos 9.
En cuanto a los tratamientos sistémicos no biológicos, la AAD describe los beneficios de la ciclosporina en dosis bajas de 3 mg/kg/d durante 4 semanas, seguido por una disminución rápida de esta y el inicio de fototerapia NB-UVB (narrowband ultraviolet B). En comparación con la monoterapia con NB-UVB, esta pauta tiene un efecto más rápido en la resolución del prurito, reduce el número de sesiones de NB-UVB y disminuye la cantidad acumulada de UVB necesaria para lograr puntajes equiparables en la escala PASI26,27.
Al contrario que la administración secuencial (indicada por su eficacia y seguridad), la administración simultánea de ciclosporina y fototerapia NB-UVB está contraindicada debido al riesgo incrementado de fotocarcinogénesis26–30.
En una revisión Cochrane sobre intervenciones para tratar el prurito de origen desconocido, un estudio proporcionó evidencia de certeza baja que sugiere que el antagonista del receptor de neurocinina 1, serlopitant, puede reducir la intensidad del prurito en comparación con placebo31. Posteriormente, en un ensayo de fase 2, Pariser et al. corroboraron este hallazgo en pacientes con psoriasis, en los que serlopitant comparado con placebo redujo el prurito de manera significativa en pacientes con enfermedad leve a moderada32.
Tratamiento del prurito con medicamentos biológicos
Tanto la guía de práctica clínica para el manejo de la psoriasis con medicamentos biológicos de la AAD como la de la JDA recomiendan el empleo de estos medicamentos en adultos con psoriasis en placas de moderada a grave, para el alivio del prurito23,33.
Si bien la definición de la gravedad de la psoriasis de la AAD está basada en parte en el índice body surface area (BSA leve: BSA <3 %; moderada: BSA = 3 % a 10 %; y grave: BSA >10 %), la enfermedad puede considerarse grave, independientemente del índice BSA, cuando trae consigo consecuencias emocionales serias; afecta zonas especiales, pero no limitadas a manos, pies, cuero cabelludo, cara o genitales; o causa prurito de difícil control33.
Por su parte, la JDA considera que los pacientes con psoriasis y un puntaje en la escala DLQI ≥10 puntos deben en general clasificarse como enfermos graves, por el impacto sobre la calidad de vida, teniendo en cuenta el DLQI como uno de los criterios para iniciar tratamiento sistémico, con independencia de los puntajes obtenidos en las escalas BSA y PASI23.
Los medicamentos biológicos autorizados por la Food and Drug Administration de los EE. UU. y aquellos disponibles en Japón para el tratamiento de la psoriasis pueden consultarse en las guías de la AAD y la JDA, Tabla XXVII y Tabla 1 respectivamente, con el fin de revisar sus denominaciones, dosis de carga y mantenimiento, y vía de administración.
En línea con lo anterior, el documento de consenso del GPs para el tratamiento de la psoriasis con terapia biológica ofrece en su Tabla 3 las indicaciones de los fármacos biológicos en distintas subpoblaciones de pacientes, incluidas algunas de las no tratadas en la presente revisión (por ejemplo, población pediátrica y embarazadas).
Conclusiones
El prurito es un síntoma común de la psoriasis, que a menudo no se reconoce. Se debe evaluar su gravedad, por ser la primera preocupación del paciente y porque no existe un tratamiento antipruriginoso específico para su tratamiento9.
El empleo de un emoliente en combinación con un corticosteroide puede utilizarse para ayudar a reducir el picor, la descamación y el porcentaje de superficie corporal, así como para prevenir la recaída rápida de la psoriasis cuando se suspenden los corticosteroides tópicos10.
Otros tratamientos sistémicos, biológicos y no biológicos, de demostrada eficacia para controlar el prurito en la psoriasis abarcan la administración secuencial de ciclosporina y fototerapia NB-UVB, serlopitant, anti-IL-17, inhibidores de JAK, inhibidores del factor de necrosis tumoral α y apremilast9,26,27.
Se necesitan más estudios con muestras de mayor tamaño, centrados en pacientes con psoriasis, que comparen el efecto de las distintas alternativas de tratamiento, teniendo como desenlace principal el prurito.
Bibliografía
- Feldman SR. Psoriasis: Epidemiology, clinical manifestations, and diagnosis. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. [citado 17 de mayo de 2022]. Disponible en: https://www.uptodate.com/contents/psoriasis-epidemiology-clinical-manifestations-and-diagnosis
- Kahremany S, Hofmann L, Harari M, Gruzman A, Cohen G. Pruritus in psoriasis and atopic dermatitis: current treatments and new perspectives. Pharmacol Rep PR. 2021;73(2):443-53. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33460006/
- Di Meglio P, Villanova F, Nestle FO. Psoriasis. Cold Spring Harb Perspect Med. 2014;4(8):a015354. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25085957/
- Griffiths CEM, Armstrong AW, Gudjonsson JE, Barker JNWN. Psoriasis. Lancet. 2021 Apr 3;397(10281):1301-1315. doi: 10.1016/S0140-6736(20)32549-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33812489/
- Tollefson MM, Crowson CS, McEvoy MT, Maradit Kremers H. Incidence of psoriasis in children: a population-based study. J Am Acad Dermatol. 2010;62(6):979-87. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3818908/
- Amatya B, Wennersten G, Nordlind K. Patients’ perspective of pruritus in chronic plaque psoriasis: a questionnaire-based study. J Eur Acad Dermatol Venereol JEADV. 2008;22(7):822-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/18422545/
- Reich A, Hrehorów E, Szepietowski JC. Pruritus is an important factor negatively influencing the well-being of psoriatic patients. Acta Derm Venereol. 2010;90(3):257-63. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20526542/
- Yosipovitch G, Goon A, Wee J, Chan YH, Goh CL. The prevalence and clinical characteristics of pruritus among patients with extensive psoriasis. Br J Dermatol. 2000;143(5):969-73. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11069504/
- Théréné C, Brenaut E, Barnetche T, Misery L. Efficacy of Systemic Treatments of Psoriasis on Pruritus: A Systemic Literature Review and Meta-Analysis. J Invest Dermatol. 2018;138(1):38-45. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28887107/
- Elmets CA, Korman NJ, Prater EF, Wong EB, Rupani RN, Kivelevitch D, et al. Joint AAD-NPF Guidelines of care for the management and treatment of psoriasis with topical therapy and alternative medicine modalities for psoriasis severity measures. J Am Acad Dermatol. 2021;84(2):432-70. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32738429/
- Lebwohl MG, Bachelez H, Barker J, Girolomoni G, Kavanaugh A, Langley RG, et al. Patient perspectives in the management of psoriasis: results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey. J Am Acad Dermatol. 2014;70(5):871-881.e1-30. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24576585/
- Reich A, Welz-Kubiak K, Rams L. Apprehension of the disease by patients suffering from psoriasis. Postepy Dermatol Alergol. 2014;31(5):289-93. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25395924/
- Krueger GG, Langley RG, Finlay AY, Griffiths CEM, Woolley JM, Lalla D, et al. Patient-reported outcomes of psoriasis improvement with etanercept therapy: results of a randomized phase III trial. Br J Dermatol. 2005;153(6):1192-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16307657/
- Mrowietz U, Chouela EN, Mallbris L, Stefanidis D, Marino V, Pedersen R, et al. Pruritus and quality of life in moderate-to-severe plaque psoriasis: post hoc explorative analysis from the PRISTINE study. J Eur Acad Dermatol Venereol JEADV. 2015;29(6):1114-20. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25376448/
- Narbutt J, Olejniczak I, Sobolewska-Sztychny D, Sysa-Jedrzejowska A, Słowik-Kwiatkowska I, Hawro T, et al. Narrow band ultraviolet B irradiations cause alteration in interleukin-31 serum level in psoriatic patients. Arch Dermatol Res. 2013;305(3):191-5. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23108364/
- Reich A, Hrehorów E, Szepietowski JC. Pruritus is an important factor negatively influencing the well-being of psoriatic patients. Acta Derm Venereol. 2010;90(3):257-63. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20526542/
- Roblin D, Wickramasinghe R, Yosipovitch G. Pruritus severity in patients with psoriasis is not correlated with psoriasis disease severity. J Am Acad Dermatol. 2014;70(2):390-1. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24438964/
- Szepietowski JC, Reich A, Wiśnicka B. Itching in patients suffering from psoriasis – Acta Dermatovenerol Croat. 2002;10(4):221-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/12588672/
- Sobell JM, Foley P, Toth D, Mrowietz U, Girolomoni G, Goncalves J, et al. Effects of Apremilast on Pruritus and Skin Discomfort/Pain Correlate With Improvements in Quality of Life in Patients With Moderate to Severe Plaque Psoriasis. Acta Derm Venereol. 2016;96(4):514-20. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26837052/
- Touw CR, Hakkaart-Van Roijen L, Verboom P, Paul C, Rutten FF, Finlay AY. Quality of life and clinical outcome in psoriasis patients using intermittent cyclosporin. Br J Dermatol. 2001;144(5):967-72. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11359382/
- Strand V, Fiorentino D, Hu C, Day RM, Stevens RM, Papp KA. Improvements in patient-reported outcomes with apremilast, an oral phosphodiesterase 4 inhibitor, in the treatment of moderate to severe psoriasis: results from a phase IIb randomized, controlled study. Health Qual Life Outcomes. 2013;11:82. Disponible en: https://pubmed.ncbi.nlm.nih.gov/23663752/
- Zhu B, Edson-Heredia E, Guo J, Maeda-Chubachi T, Shen W, Kimball AB. Itching is a significant problem and a mediator between disease severity and quality of life for patients with psoriasis: results from a randomized controlled trial. Br J Dermatol. 2014;171(5):1215-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24749812/
- Saeki H, Terui T, Morita A, Sano S, Imafuku S, Asahina A, et al. Japanese guidance for use of biologics for psoriasis (the 2019 version). J Dermatol. 2020;47(3):201-22. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31916326/
- Carrascosa JM, Puig L, Belinchón Romero I, Salgado-Boquete L, Del Alcázar E, Andrés Lencina JJ, et al. Practical update of the Recommendations Published by the Psoriasis Group of the Spanish Academy of Dermatology and Venereology (GPS) on the Treatment of Psoriasis with Biologic Therapy. Part 1. Concepts and General Management of Psoriasis with Biologic Therapy. Actas Dermosifiliogr. 2022;113(3):261-77. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35526919/
- Cassano N, Mantegazza R, Battaglini S, Apruzzi D, Loconsole F, Vena GA. Adjuvant role of a new emollient cream in patients with palmar and/or plantar psoriasis: a pilot randomized open-label study. G Ital Dermatol Venereol. 2010;145(6):789-92. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21139557/
- Calzavara-Pinton P, Leone G, Venturini M, Sala R, Colombo D, La Parola IL, et al. A comparative non randomized study of narrow-band (NB) (312 +/- 2 nm) UVB phototherapy versus sequential therapy with oral administration of low-dose Cyclosporin A and NB-UVB phototherapy in patients with severe psoriasis vulgaris. Eur J Dermatol EJD. 2005;15(6):470-3. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16280301/
- Menter A, Gelfand JM, Connor C, Armstrong AW, Cordoro KM, Davis DMR, et al. Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management of psoriasis with systemic nonbiologic therapies. J Am Acad Dermatol. 2020;82(6):1445-86. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32119894/
- van de Kerkhof PC. Therapeutic strategies: rotational therapy and combinations. Clin Exp Dermatol. 2001;26(4):356-61. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11422189/
- Naldi L. Malignancy concerns with psoriasis treatments using phototherapy, methotrexate, cyclosporin, and biologics: facts and controversies. Clin Dermatol. 2010;28(1):88-92. Disponible en: https://pubmed.ncbi.nlm.nih.gov/20082957/
- Lebwohl M, Ali S. Treatment of psoriasis. Part 2. Systemic therapies. J Am Acad Dermatol. 2001;45(5):649-61; quiz 662-4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11606913/
- Andrade A, Kuah CY, Martin-Lopez JE, Chua S, Shpadaruk V, Sanclemente G, et al. Interventions for chronic pruritus of unknown origin. Cochrane Database Syst Rev. 2020;1:CD013128. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31981369/
- Pariser DM, Bagel J, Lebwohl M, Yosipovitch G, Chien E, Spellman MC. Serlopitant for psoriatic pruritus: A phase 2 randomized, double-blind, placebo-controlled clinical trial. J Am Acad Dermatol. 2020;82(6):1314-20. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32007513/
- Menter A, Strober BE, Kaplan DH, Kivelevitch D, Prater EF, Stoff B, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol. 2019;80(4):1029-72. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30772098/