Patología
La psoriasis es una enfermedad sistémica inflamatoria crónica mediada por el sistema inmunitario que afecta a la piel y que se asocia con frecuencia a daño articular y a otras comorbilidades de diferente naturaleza1.
La psoriasis en placas ―el tipo más frecuente de psoriasis― se caracteriza por placas eritematosas bien delimitadas, cubiertas de escamas nacaradas1 (Figura 1).
Figura 1. Psoriasis en placas

La psoriasis es una enfermedad sistémica que se asocia a diversas enfermedades: artritis, obesidad, síndrome metabólico, hipertensión, diabetes, arterioesclerosis, cáncer, nefropatía, hepatopatía, enfermedades autoinmunes (por ejemplo, enfermedad inflamatoria intestinal y enfermedad celíaca) y trastornos psiquiátricos, entre otras patologías2.
Además, los pacientes con psoriasis ven reducida su calidad de vida y están más expuestos al estigma social y la discriminación3.
La evolución de la enfermedad es variable e impredecible, pero suele presentar un curso crónico con exacerbaciones y remisiones. El diagnóstico es clínico y no existe ninguna prueba específica para establecerlo. La biopsia no suele ser necesaria, pero puede ayudar al diagnóstico diferencial1.
¿Es frecuente la psoriasis?
La psoriasis afecta a más de 125 millones de personas en todo el mundo4. La prevalencia mundial varía en función de la población, pero se estima del 0,5 % al 11,4 % en adultos y del 0 % al 1,4 % en niños3. En la mayoría de los países desarrollados, la prevalencia está entre el 1,5 % y el 5 %5. No obstante, una revisión sistemática más reciente, de 2020, establece una prevalencia menor, de entre el 0,14 % y el 1,99 %6. En cualquier caso, parece que la incidencia está aumentando1,4,5.
La incidencia de la psoriasis varía según la región geográfica y es mayor en los países más distantes del ecuador1. También es más frecuente en países con ingresos altos y en regiones con poblaciones más envejecidas6.
En España, la prevalencia de la psoriasis aumentó desde el 1,4 % en 2001 hasta el 2,3 % en 2014, debido al mejor diagnóstico de la enfermedad7.
Un estudio más reciente, publicado en 2019, mostró una prevalencia del 2,69 %8.
La psoriasis afecta a ambos sexos por igual y aparece a cualquier edad, aunque es menos frecuente en niños que en adultos1,4–6. La frecuencia de aparición de la psoriasis muestra dos picos de edad: entre los 30 y los 39 años y entre los 50 y 69 años1.
¿Cuáles son las causas y factores de riesgo?
La causa de la psoriasis no se conoce completamente; sin embargo, se han descrito múltiples factores de riesgo. La predisposición genética es un factor contribuyente clave, al cual se suman una serie de factores de riesgo ambientales, de los cuales destacan el tabaco, la obesidad y el consumo de alcohol1.
La psoriasis tiene un importante componente genético, sobre el que actúan desencadenantes ambientales y conductuales1.
Factores genéticos
La psoriasis tiene una fuerte base genética poligénica. Aproximadamente, el 40 % de las personas con psoriasis o artritis psoriásica tienen antecedentes familiares de la enfermedad. Además, la tasa de concordancia entre gemelos monocigóticos es de 2 a 3,5 veces mayor que entre gemelos dicigóticos4.
Se han identificado más de 70 genes asociados a la psoriasis4. El principal determinante genético es el locus de susceptibilidad a la psoriasis 1 (PSORS1, también conocido como HLA-C), que contiene genes que codifican para el complejo mayor de histocompatibilidad (CMH)1,4. El CMH codifica los antígenos leucocitarios humanos (HLA) y contribuye a aproximadamente el 40 % de la heredabilidad conocida de la enfermedad4.
Factores de riesgo y desencadenantes
Existen varios factores que pueden desencadenar o empeorar la psoriasis (Cuadro 1):
- Obesidad. La prevalencia de la psoriasis es mayor en los pacientes con obesidad, incluidos los niños. También existe una correlación entre la gravedad de la psoriasis y la prevalencia de obesidad. No se conoce claramente la fisiopatología de esta asociación. Una hipótesis es que la repercusión psicosocial negativa de la psoriasis aumentaría el riesgo de obesidad, pero cada vez hay más pruebas de que es al revés: la obesidad es un factor de riesgo para la psoriasis. Es relevante el hecho de que la psoriasis sea una enfermedad inflamatoria sistémica y la obesidad supone un estado proinflamatorio2.
- Tabaquismo. La prevalencia de psoriasis es mayor en las personas que fuman, así como en las que ya lo han dejado. El riesgo de aparición de psoriasis en personas fumadoras es el doble que en las no fumadoras2.
- Ingesta de alcohol. El consumo de alcohol es mayor en las personas con psoriasis. Se cree también que el alcohol contribuye a la aparición de psoriasis y a la mayor gravedad de la enfermedad2.
- Daño de la barrera cutánea. El fenómeno de Koebner ―es decir, la provocación de lesiones psoriásicas por una alteración de la piel, como la provocada por arañazos, piercings, tatuajes, quemaduras solares o irritantes químicos9― está presente en alrededor del 25 % de los pacientes con psoriasis, aunque no es patognomónico. El período de latencia entre el traumatismo y la aparición de las lesiones de psoriasis es generalmente de 2 a 6 semanas10.
- Infecciones. Tanto las infecciones bacterianas como las víricas pueden asociarse a un empeoramiento de la psoriasis. Por ejemplo, el virus de la inmunodeficiencia humana (VIH) puede provocar la aparición o el empeoramiento de la psoriasis, y la faringitis estreptocócica es un desencadenante común de la psoriasis guttata o psoriasis infantil1.
- Fármacos. Muchos fármacos pueden desencadenar psoriasis o producir lesiones psoriasiformes. Los más frecuentemente implicados son los bloqueantes β, el litio y los antipalúdicos. Paradójicamente, los inhibidores del factor de necrosis tumoral, que se usan para tratar la psoriasis, pueden ocasionalmente provocar erupciones psoriasiformes1. El descenso rápido de los corticoides sistémicos puede causar psoriasis pustulosa y reagudizar la psoriasis en placas10.
- Estrés. El estrés es un factor citado con frecuencia como desencadenante de la psoriasis1; se asocia tanto a debuts como a reagudizaciones de la enfermedad10. No obstante, aunque hay varias revisiones sistemáticas que avalan esta asociación11,12, un metanálisis de 39 estudios que incluían 32 537 pacientes no encontró suficientes pruebas para confirmarla13.
- Factores endocrinos. La hipocalcemia es un factor desencadenante de psoriasis pustulosa generalizada. El rol de la vitamina D no está claro. Aunque los análogos de la vitamina D3 activa mejoran la psoriasis, no se ha demostrado que una concentración anómala de esta vitamina desencadene psoriasis10.
- Embarazo. La psoriasis puede mejorar, empeorar o mantenerse estable durante el embarazo. También pueden desarrollar psoriasis pustulosa (antes denominada impétigo herpetiforme), una forma rara de psoriasis pustulosa generalizada que puede ocurrir, por lo general, en el tercer trimestre del embarazo1.
- Clima y exposición solar. Se cree que el clima y la exposición solar afectan a la prevalencia de la psoriasis. La psoriasis cutánea y la artritis psoriásica empeoran en invierno y mejoran en verano9. En los meses fríos, los brotes son más comunes debido a la sequedad del aire, la menor exposición a la luz solar y las bajas temperaturas14.
Cuadro 1. Factores de riesgo y desencadenantes de la psoriasis
| Obesidad Tabaquismo Ingesta de alcohol Traumatismos Infecciones Fármacos Estrés Hipocalcemia |
Fuente: elaboración propia a partir de Feldman1 y Van de Kerkhof y otros10
¿Cuál es la fisiopatología de la psoriasis?
La psoriasis se caracteriza por una proliferación anormal de los queratinocitos, inflamación e infiltración de células inmunitarias en la dermis y la epidermis, lo que se manifiesta a través de cambios histopatológicos característicos en la mayoría de las células cutáneas presentes en estas dos capas de la piel4,9.
El desequilibrio del sistema inmunitario tiene un papel importante en la fisiopatología de la psoriasis. Está implicado el sistema inmunitario tanto innato como adaptativo9. Las interacciones entre las células dendríticas, los linfocitos T, los queratinocitos, los neutrófilos y las citocinas liberadas de las células del sistema inmunitario contribuyen al inicio y cronificación de la inflamación cutánea que caracteriza la psoriasis15.
El desequilibrio del sistema inmunitario es una alteración clave en la fisiopatología de la psoriasis. Esto tiene implicaciones en el tratamiento15.
La secuencia inmunológica que se cree que ocurre en la psoriasis se resume como sigue15:
- El antígeno contribuye a la activación cutánea de las células dendríticas plasmacitoides y otras células del sistema inmunitario innato.
- Estas células del sistema inmunitario innato producen citocinas proinflamatorias —como el interferón α (IFN-α)— que estimulan la activación y migración de diferentes células dendríticas mieloides.
- Las células dendríticas mieloides y los macrófagos activados producen otros mediadores proinflamatorios ―como el factor de necrosis tumoral α (TNF α), la interleucina 12 (IL‑12) y la interleucina 23 (IL-23)―, que atraen y estimulan la diferenciación y activación de los linfocitos Th1, Th17, Th22 y linfocitos T citotóxicos.
- Los linfocitos T reclutados producen citocinas ―sobre todo, IL-17 e IL-22― que actúan sinérgicamente con otras citocinas para que los queratinocitos proliferen, lo cual está en la base de las lesiones típicas de la psoriasis. Los queratinocitos, además, también liberan citocinas y péptidos antimicrobianos proinflamatorios.
- Todas estas sustancias proinflamatorias producidas por las células inmunitarias y por los queratinocitos perpetúan el proceso inflamatorio mediante complejos bucles de retroalimentación.
¿Cuáles son sus manifestaciones clínicas?
La psoriasis puede adoptar diversos aspectos clínicos, tanto respecto a la lesión elemental de la piel como a la localización. El grado de afectación de la piel también es variable1,4.
La mayoría de los tipos de psoriasis evolucionan de forma cíclica, con períodos de exacerbación sintomática o brotes que suelen durar unas semanas o meses y luego disminuyen durante un tiempo o, incluso, entran en un período de remisión4.
Tipos clínicos de psoriasis
La psoriasis puede manifestarse de varias formas clínicas, que incluso pueden coexistir en un mismo individuo4.
Todas las formas clínicas pueden presentar picor, ardor, dolor y sangrado4,9
Psoriasis en placas
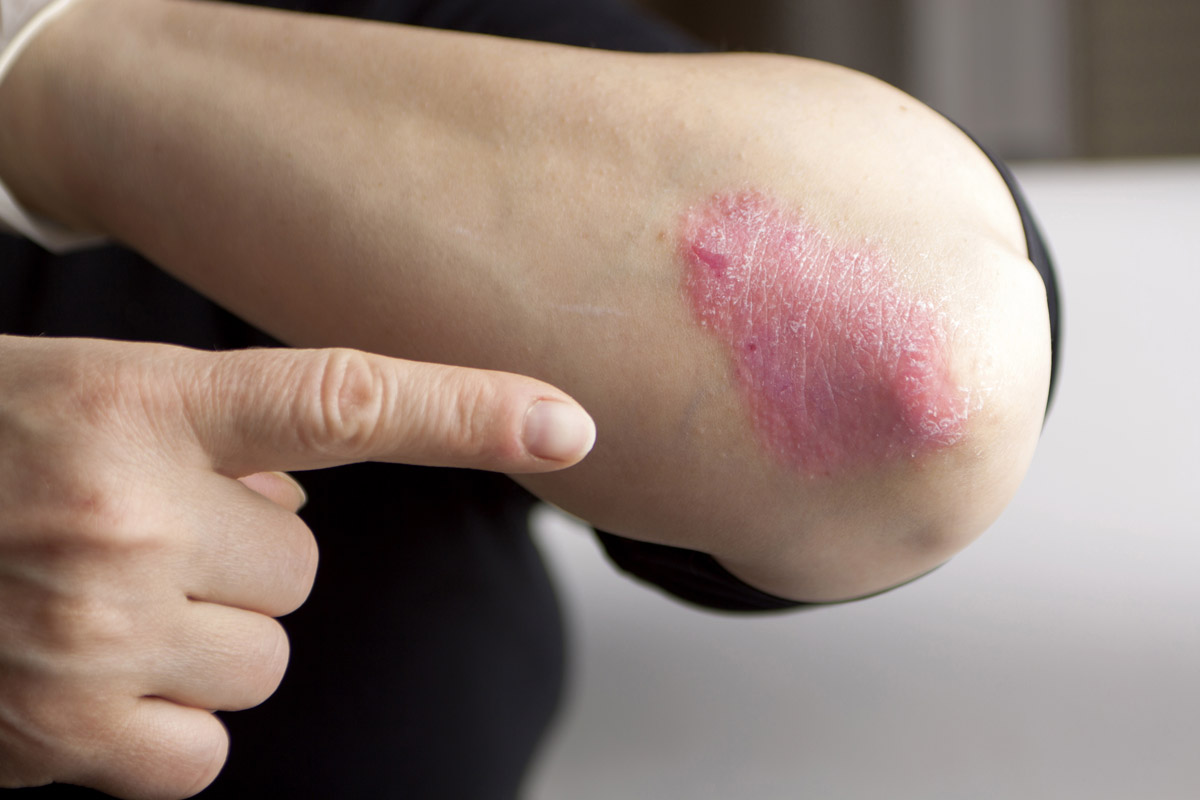
También se conoce como psoriasis vulgaris o psoriasis vulgar. Es el tipo más frecuente de psoriasis (90 % de los casos)9. Se caracteriza por placas eritematosas bien delimitadas y cubiertas de una gruesa capa de escamas plateada (Figura 2), aunque el baño y los emolientes pueden invisibilizarla (Figura 3). En los pacientes con piel oscura, la hiperpigmentación posinflamatoria puede oscurecer el eritema1.
Figura 2. Psoriasis en placas, con escamas plateadas
Las placas pueden variar de menos de 1 cm a más de 10 cm de diámetro y suelen tener una presentación simétrica. Las rodillas, codos, cuero cabelludo y zona sacra son las zonas que con más frecuencia se afectan1. La psoriasis del cuero cabelludo aparece en el 75 %-90 % de los casos9.
Figura 3. Psoriasis en el codo, con pocas escamas
Dos signos frecuentes de la psoriasis en placas son el de Koebner y el de Auspitz, aunque ni su presencia ni su ausencia confirman ni excluyen el diagnóstico1:
- Fenómeno de Koebner: consiste en la aparición de lesiones de psoriasis en zonas de traumatismos. También puede ocurrir en otras enfermedades, como el liquen plano y el vitíligo.
- Signo de Auspitz: sangrado puntiforme que aparece al retirar la escama de una placa de psoriasis.
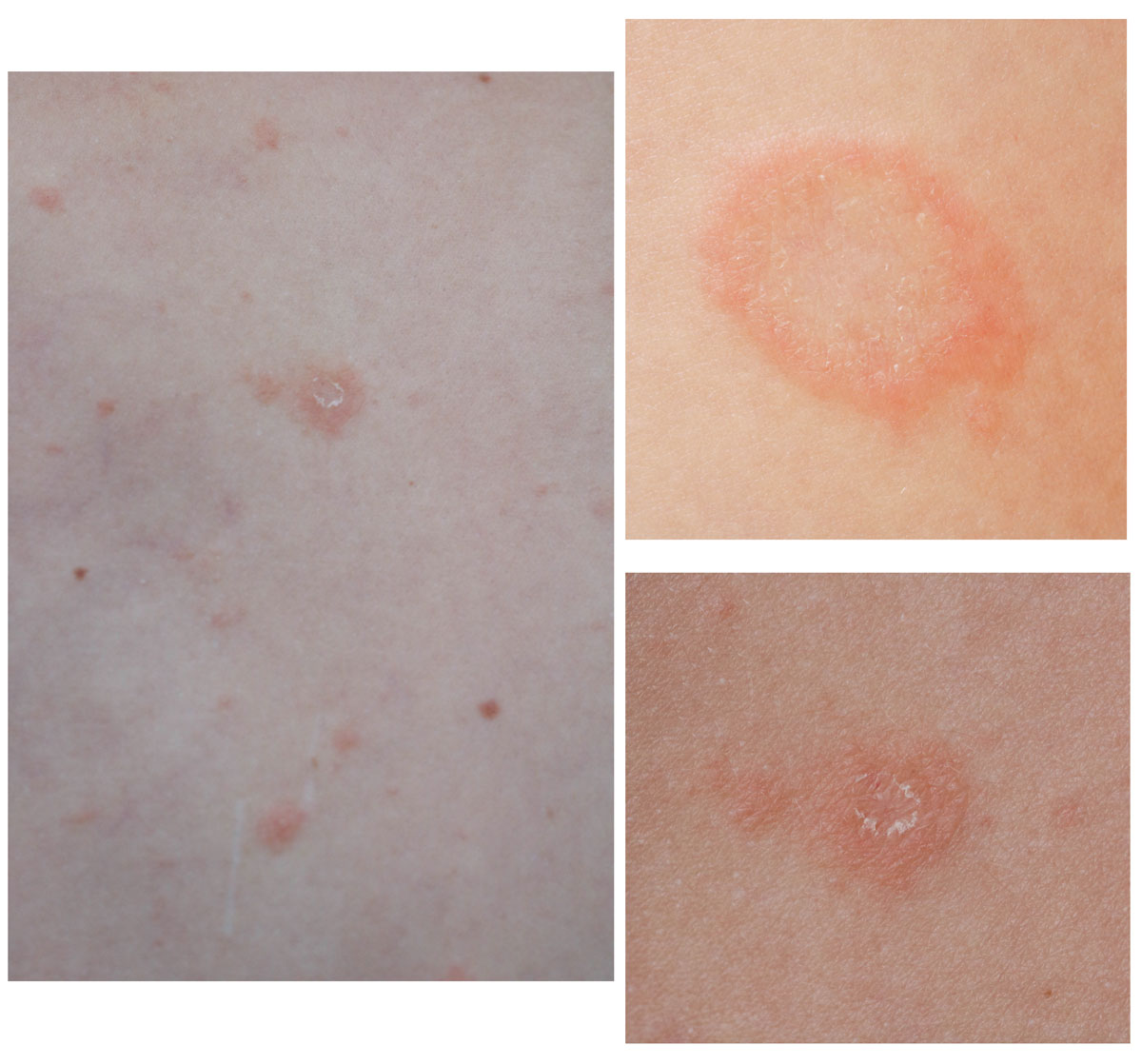
Psoriasis guttata o en gotas
También se denomina psoriasis infantil, ya que menudo aparece por primera vez en niños o jóvenes sin antecedentes de psoriasis. No obstante, también puede aparecer en pacientes con psoriasis preexistente. El desencadenante generalmente es una infección, sobre todo, una faringitis estreptocócica1,9.
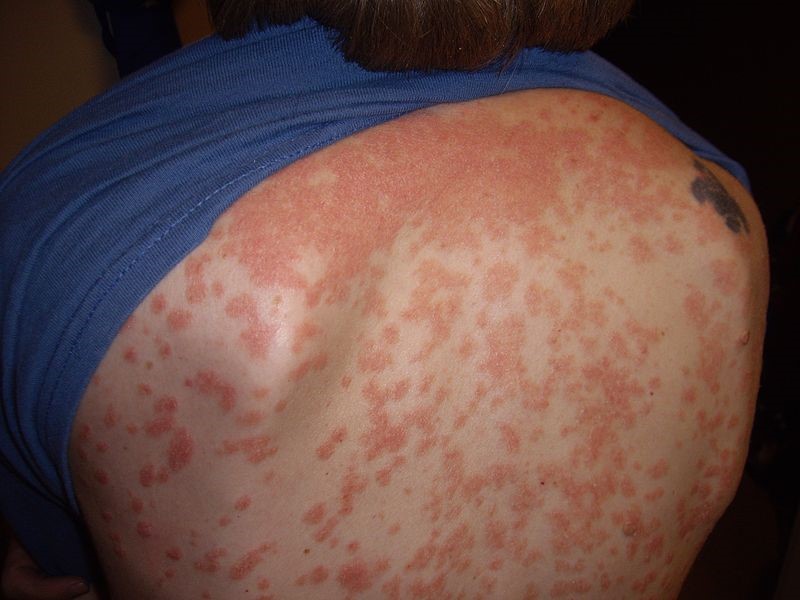
Se caracteriza por la abrupta aparición de placas y pápulas psoriásicas, por lo general menores de 1 cm (de ahí el nombre «en gotas»). Las localizaciones típicas son el tronco y la raíz de las extremidades1 (Figura 4).
La psoriasis guttata puede desaparecer espontáneamente ―por lo general, en semanas o meses―, persistir o convertirse en psoriasis crónica en placas16. Un tercio de los niños con psoriasis guttata desarrollarán psoriasis en placas en el futuro9.
Figura 4. Psoriasis en gotas
Fuente: Wikipedia (autor: Bobjgalindo)
Psoriasis pustulosa
Este tipo de psoriasis se caracteriza por pústulas estériles sobre una base eritematosa. La psoriasis pustulosa puede ser grave, incluso mortal. Clínicamente, se distinguen las formas generalizadas y las formas localizadas17.
Dentro de las formas generalizadas, hay dos presentaciones:
- Psoriasis pustulosa generalizada aguda. También se denomina psoriasis pustulosa generalizada de Von Zumbusch. Se caracteriza por el inicio repentino, en un paciente con o sin psoriasis previa diagnosticada, de placas de color rojo intenso, edematosas y dolorosas, que pronto se tapizan de pequeñas pústulas agrupadas y cubiertas por una membrana fina. Pueden confluir y formar amplias capas superficiales de color blanco amarillento17,18. Las «tandas» o brotes de pústulas pueden sucederse en la misma zona o en zonas adyacentes18.
El paciente presenta alteración del estado general, escalofríos y fiebre elevada. También puede presentar artritis, lengua geográfica, balanopostitis, ictericia y alteraciones oculares17,18.
Las pústulas se desecan en unos días y dejan paso a un extenso eritema con descamación17. Las fases eritematosa, pustulosa y escamosa pueden coexistir en una misma persona18.
Este tipo de psoriasis puede aparecer en el embarazo; antes se denominaba impétigo herpetiforme17. Suele ocurrir en el tercer trimestre, aunque también puede hacerlo antes, o en el posparto inmediato. Las lesiones aparecen en los pliegues y desde ahí se extienden. La repercusión general puede ser importante, con posibles complicaciones fetales. Tiende a recidivar en embarazos posteriores19.
- Psoriasis pustulosa anular generalizada. También se denomina psoriasis pustulosa generalizada subaguda. Se presenta como una erupción recurrente de placas eritematosas descamativas anulares con pústulas en la periferia. Las lesiones evolucionan centrífugamente a lo largo de horas o días. Dejan descamación residual17. Los signos sistémicos son leves18.
Dentro de las formas localizadas, también hay dos presentaciones:
- Acrodermatitis de Hallopeau. También se llama psoriasis pustulosa acral o acrodermatitis pustulosa continua. Afecta exclusivamente a una o más falanges distales de las manos (más frecuente) o los pies, en la zona periungueal. Las pústulas pueden coalescer y también romperse, dejando un eritema brillante e hiperqueratosis17.
La afectación crónica del lecho ungueal puede llevar a onicodistrofia y desaparición de las uñas. Puede, incluso, haber atrofia y osteólisis de la falange distal. Raramente, la enfermedad puede derivar en psoriasis pustulosa generalizada17.
- Psoriasis pustulosa palmoplantar. Existe controversia sobre si es realmente un tipo de psoriasis o una entidad diferente que se da con más frecuencia en personas con psoriasis. El tabaquismo favorece su desarrollo17.
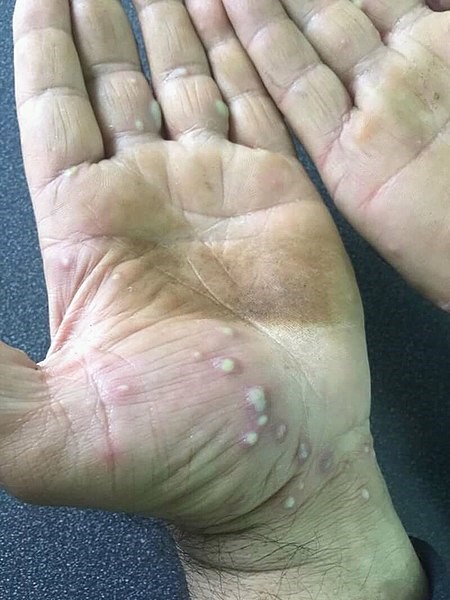
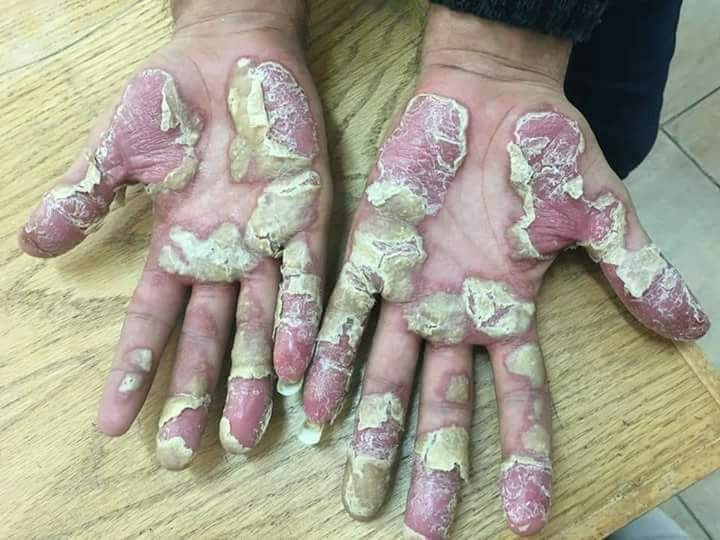
Se caracteriza por grupos de pústulas blancas o amarillo-marronáceas, eritema y descamación en las palmas y las plantas (Figura 5)17. Las pústulas son profundas y, al confluir, adoptan un aspecto de capa pustulosa más o menos extensa (Figura 6)18. El picor, dolor y quemazón pueden ser intensos y muy limitantes17.
Figura 5. Psoriasis pustulosa palmoplantar
Fuente: Wikipedia (autor: Masryyy)
Figura 6. Psoriasis pustulosa palmoplantar
Fuente: Wikipedia (autor: Mohammad2018)
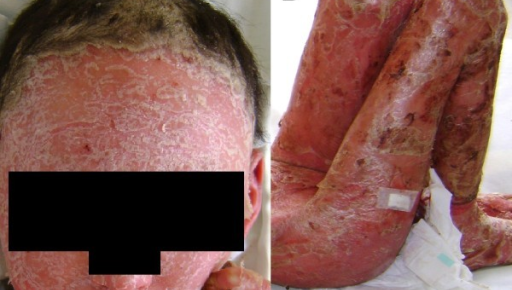
Psoriasis eritrodérmica
La psoriasis eritrodérmica (Figura 7) es la forma más grave de psoriasis y puede ser mortal, debido, sobre todo, a las infecciones y la pérdida de fluidos por la pérdida de la barrera cutánea1. Provoca un eritema generalizado y descamación de la piel en capas en todo o casi todo el cuerpo, lo cual causa un intenso picor y dolor. Afecta a alrededor del 3 % de las personas con psoriasis y se presenta generalmente en los pacientes con psoriasis vulgar inestable4.
Figura 7. Psoriasis eritrodérmica
Fuente: Teran CG, Teran-Escalera CN, Balderrama C. J Med Case Rep. 2010;15;4:179. Licencia CC BY 2.0.
Psoriasis en localizaciones especiales
La presentación de la psoriasis en algunas localizaciones adquiere ciertas peculiaridades.
Psoriasis inversa o de los pliegues
Esta forma de psoriasis se caracteriza por la aparición de placas eritematosas bien delimitadas, lisas y brillantes en los pliegues inguinal, perineal, genital, interglúteo, axilar o inframamario. Se denomina inversa porque es la presentación contraria a la típica de la psoriasis en placas, en las superficies extensoras. Debido al aumento de humedad en estas zonas, las lesiones a menudo carecen de escamas. Se confunden con frecuencia con intertrigos micóticos o bacterianos1. Muchos afectados de psoriasis inversa desarrollan otros subtipos de psoriasis de manera simultánea4.
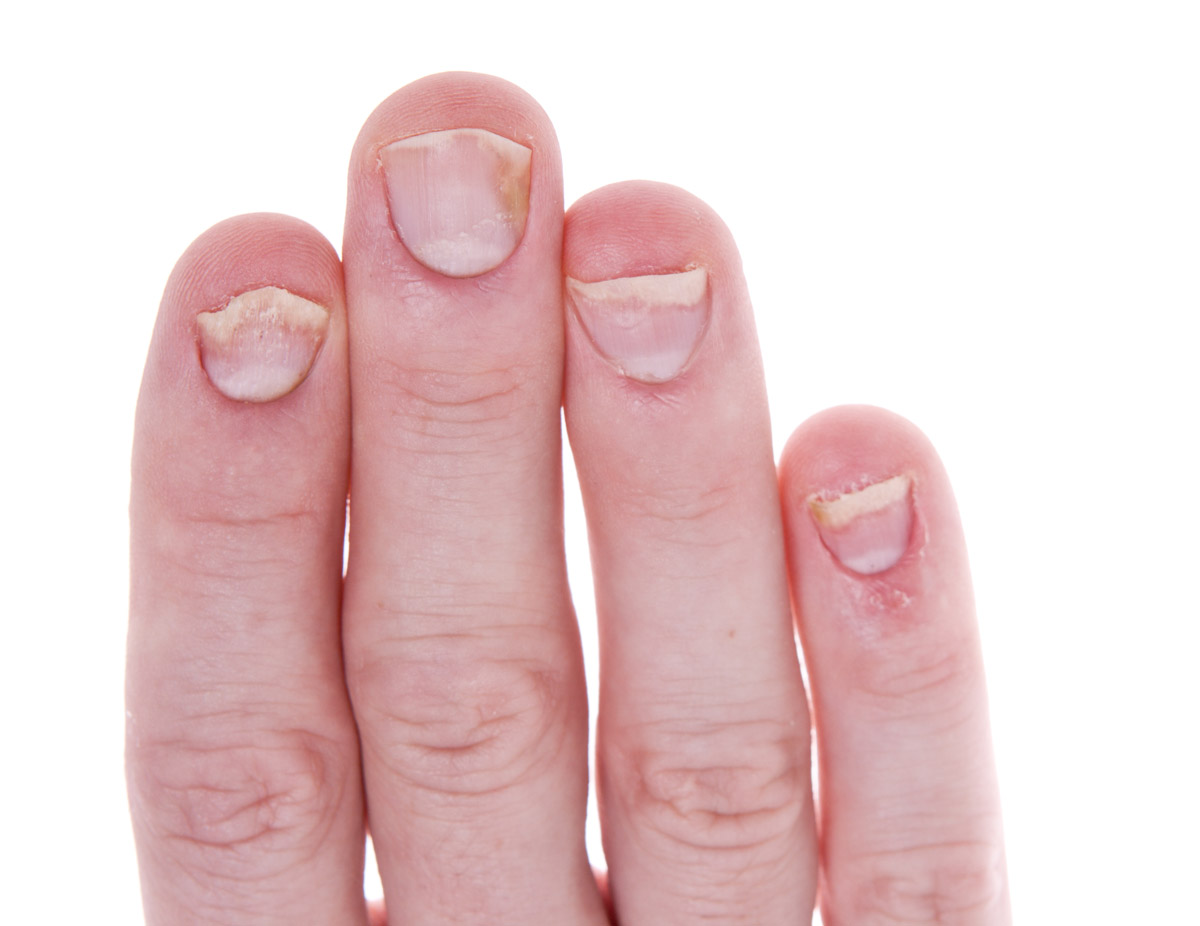
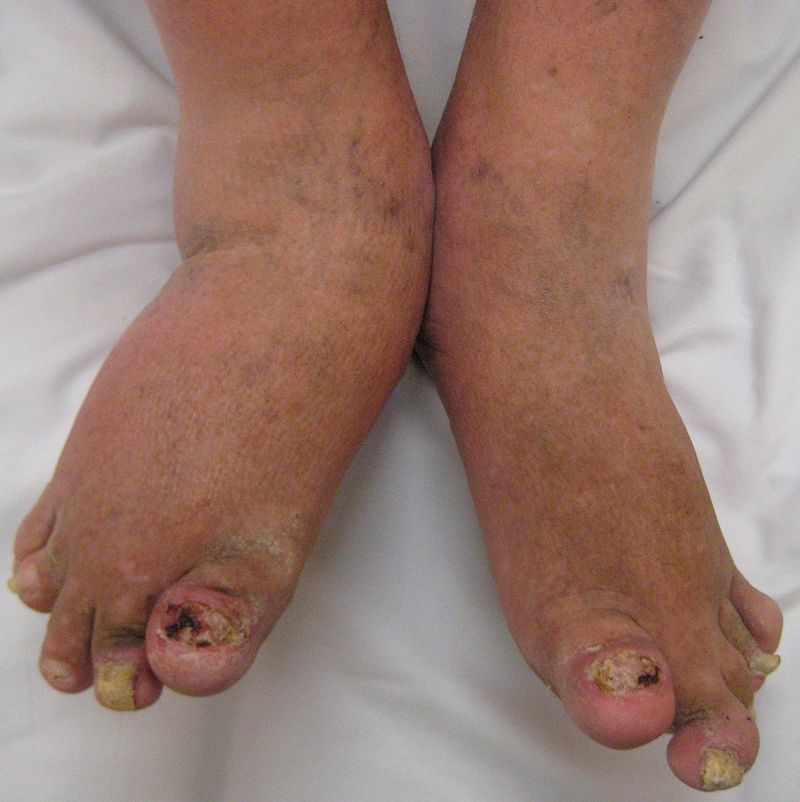
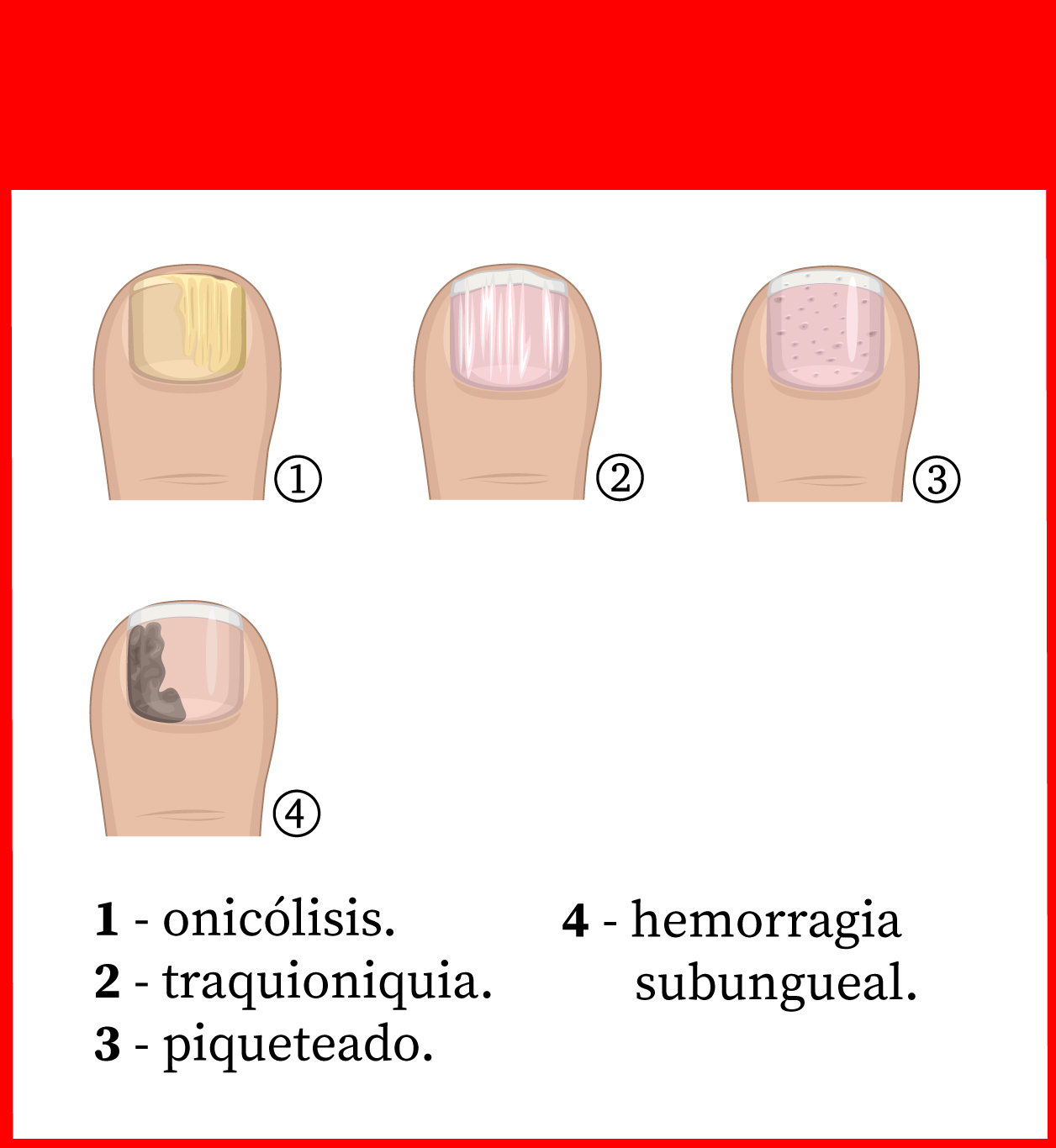
Psoriasis ungueal
La psoriasis ungueal (Figura 8) afecta a alrededor del 50 % de los pacientes con psoriasis en el momento del diagnóstico, con una incidencia de por vida del 80-90 %. Es más frecuente en pacientes con artritis psoriásica (hasta el 90 %)9. Aunque lo más frecuente es que aparezca después de las lesiones en la piel, también pueden precederlas o, incluso, ser la única manifestación (5 %)1.
Figura 8. Psoriasis ungueal
Las lesiones más frecuentes de la psoriasis de las uñas son el piqueteado ungueal y la onicólisis distal18:
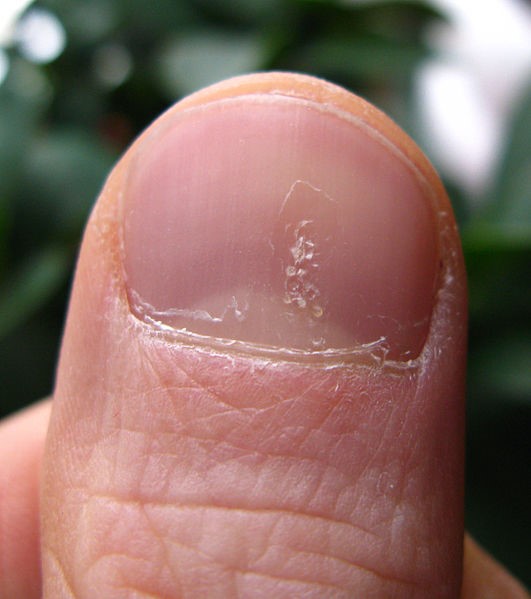
- Piqueteado (pitting) ungueal o «uña en dedal». Son depresiones punteadas cupuliformes que dan a la uña un aspecto de dedal (Figura 9). Deben buscarse minuciosamente, ya que a veces son poco visibles.
- Onicólisis psoriásica. La parte distal de la uña se despega y es de color grisáceo, con un ribete proximal amarillento o cobrizo.
Estos signos pueden asociarse a hiperqueratosis subungueal, a veces muy gruesa. Cuando se afecta el lecho ungueal, puede apreciarse un cambio de color en la uña, que recuerda al del aceite de motor nuevo; estas manchas ovales se llaman «manchas de aceite». También puede haber hemorragias subungueales en llamarada1,18.
Figura 9. Piqueteado ungueal típico de la psoriasis
Fuente: Wikipedia (autor: Seenms)
Psoriasis palmoplantar
La psoriasis en estas localizaciones puede tener características peculiares. La presentación típica consiste en placas eritematosas e hiperqueratósicas, a veces con fisuras dolorosas que pueden ser muy incapacitantes. Es habitual la coexistencia de psoriasis ungueal1.
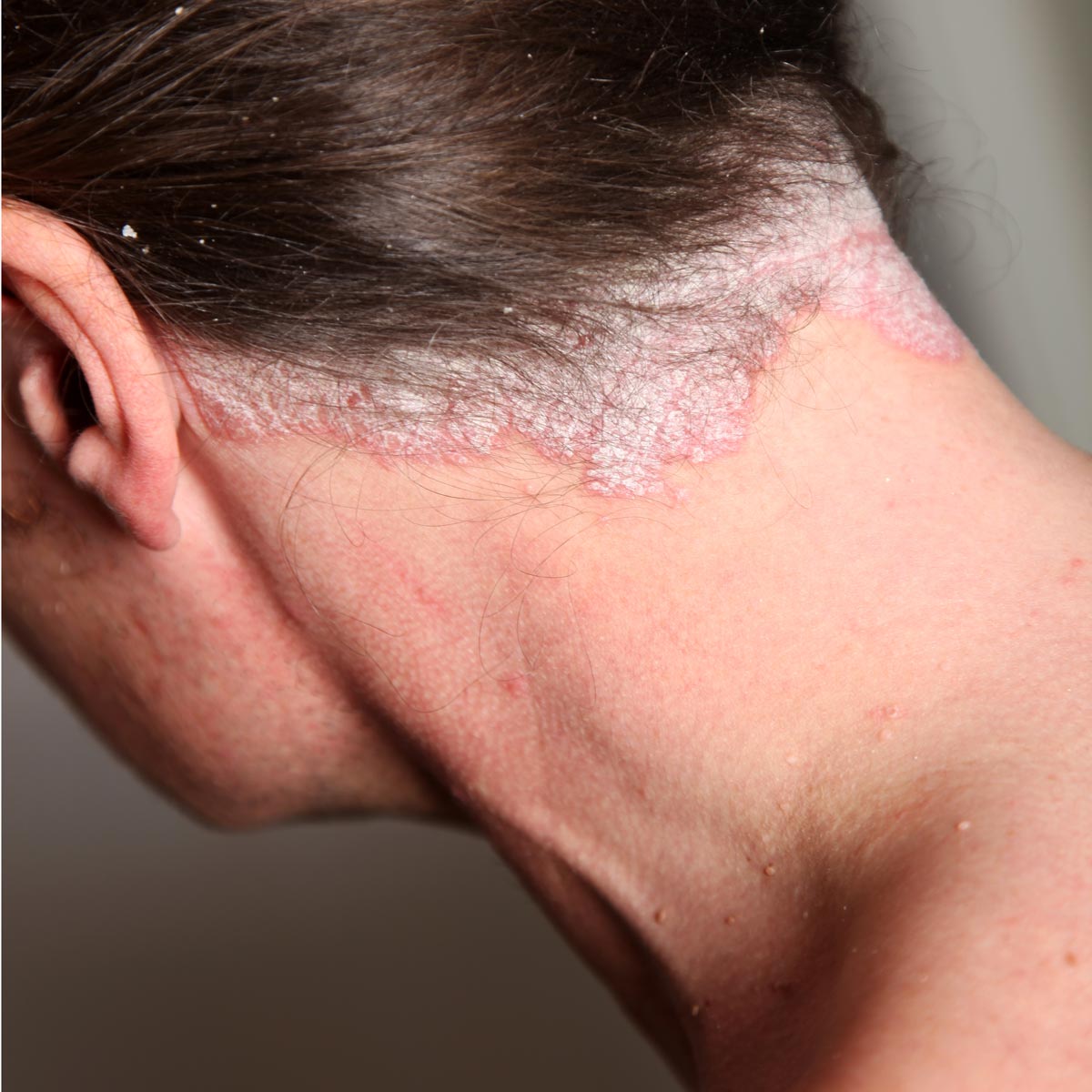
Psoriasis en el cuero cabelludo
En más del 80 % de los casos, la psoriasis del cuero cabelludo (Figura 10) se asocia a una forma clásica de psoriasis, pero puede presentarse de manera aislada18. Puede manifestarse en forma de caspa poco intensa, de placas eritematoescamosas bien delimitadas o de un verdadero casco costroso que afecta a la base del pelo. La alopecia es muy rara19. Los cabellos atraviesan las placas escamosas secas sin quedar pegados, al contrario de lo que ocurre en la dermatitis seborreica18.
Figura 10. Psoriasis del cuero cabelludo
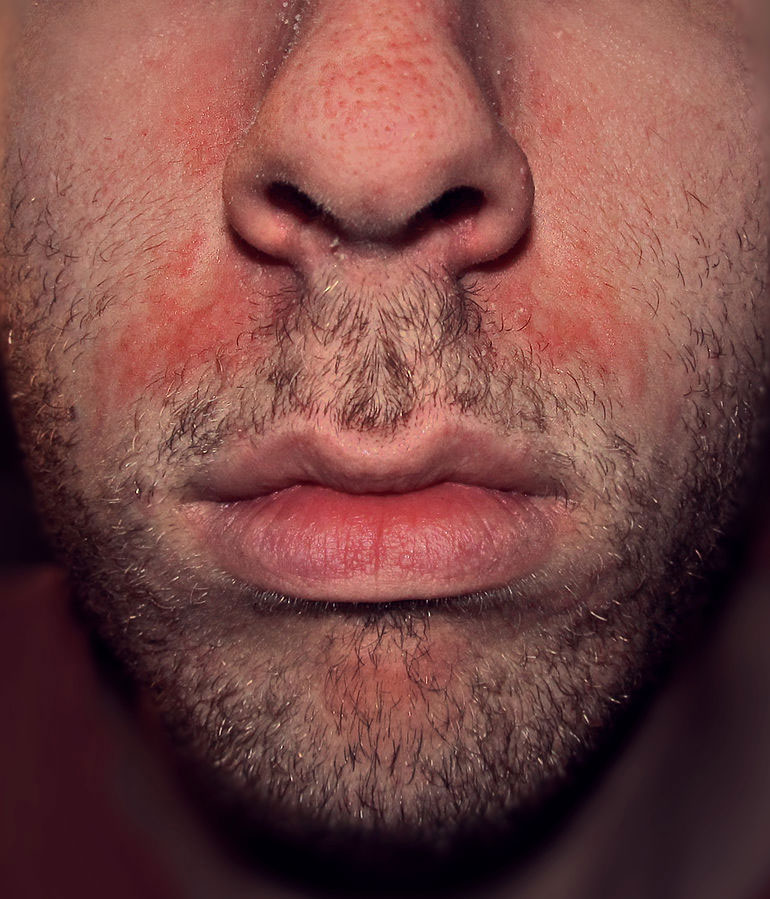
Psoriasis facial
Es infrecuente (menos del 5 % de los pacientes). Puede ser una extensión de la del cuero cabelludo. Puede tener una distribución centrofacial y ser difícil de distinguir de la dermatitis seborreica18.
Psoriasis en las mucosas
La lesión de las mucosas es infrecuente y se observa más en la psoriasis pustulosa. Suele presentarte en forma de placas eritematosas lisas, bien delimitadas. Afecta con más frecuencia a la región genital (balanopostitis eritematosa crónica, de diagnóstico difícil cuando se presenta de forma aislada)18 que a la zona bucolingual (lengua geográfica)19.
¿Qué enfermedades se asocian a la psoriasis?
La psoriasis es una enfermedad inflamatoria multisistémica cuyas manifestaciones clínicas no se limitan a la piel. De hecho, se estima que el 73 % de los pacientes con psoriasis tiene, al menos, una enfermedad concomitante20.
Las enfermedades asociadas a la psoriasis pueden aparecer debido a factores de riesgo compartidos, como la predisposición genética y la exposición medioambiental, o pueden estar relacionadas con la naturaleza inflamatoria crónica de la psoriasis, que puede causar, por ejemplo, resistencia a la insulina21.
La detección temprana y el tratamiento adecuado de estas enfermedades es importante, dado que podría prevenir su evolución a fases más graves21.
La psoriasis se asocia, entre otras patologías (Cuadro 2), a síndrome metabólico, artritis psoriásica, diabetes, enfermedades cardiovasculares, enfermedad inflamatoria intestinal, cáncer y trastornos psiquiátricos2,20–22.
Cuadro 2. Enfermedades con prevalencia aumentada en los pacientes con psoriasis
|
Fuente: elaboración propia a partir de Korman2.
Artritis psoriásica
La artritis psoriásica (Figura 11) es una enfermedad inflamatoria articular que se asocia a la psoriasis. Se estima que entre un 6 % y un 41 % de los pacientes con psoriasis desarrollan artritis psoriásica23.
Las lesiones de la piel preceden a la artritis en el 85 % de los casos (en promedio, 10 años)23. Afecta a hombres y mujeres por igual, y en la mayoría de los casos aparece entre los 30 y los 50 años de edad21.
Existe una débil relación entre la gravedad de la psoriasis cutánea y la afectación articular. Solo una minoría de los pacientes nota una relación entre la actividad de las lesiones cutáneas y las manifestaciones articulares, aunque en algunos estudios (incluido un metanálisis publicado en 202223) se ha encontrado que la artritis psoriásica ocurre con más frecuencia en pacientes con psoriasis grave24.
Debe descartarse artritis psoriásica en todos los pacientes con psoriasis2.
Las manifestaciones clínicas de la artritis psoriásica en el aparato locomotor no se limitan a la presencia de artritis, sino que también puede haber entesitis, dactilitis y afectación axial24. Puede ser poliarticular, oligoarticular o monoarticular, y estos patrones no tienen por qué ser siempre iguales en el curso evolutivo de la enfermedad21,24.
La inflamación articular se manifiesta con dolor, hinchazón, calor y dificultad de movimiento. El dolor es de características inflamatorias21:
- Duele todo el día, a veces más al levantarse.
- Aumenta con la actividad y el ejercicio, aunque a veces se alivia con el ejercicio.
- Presente en reposo, incluso nocturno.
- Se acompaña de rigidez matutina que dura más de 30 minutos (a veces, horas).
- Respuesta favorable a los antiinflamatorios.
Puede afectar a articulaciones tanto axiales como periféricas, pero la presentación clínica más habitual es la artritis oligoarticular asimétrica, que afecta a ≤3 articulaciones de las extremidades21,25.
Se puede afectar cualquier articulación, aunque las que lo hacen con mayor frecuencia son las de los pies, manos, rodillas, tobillos, hombros y codos4.
La artritis de las articulaciones interfalángicas distales ―por lo general, con afectación ungueal― es la más típica y supone un rasgo diferencial con la artritis reumatoide, aunque no es la forma de presentación más frecuente25.
La dactilitis o «dedo en salchicha» es otro signo característico de la artritis psoriásica, aunque no patognomónico. Es la tumefacción difusa de todo el dedo. Afecta a casi la mitad de los pacientes con artritis psoriásica y se asocia a mayor riesgo de24
La entesopatía o inflamación de la entesis es más frecuente en las formas axiales y su localización más habitual es el tendón de Aquiles25.
La afectación axial se relaciona con el marcador genético HLA B2725. Casi el 50 % de los pacientes padecen afectación periférica y axial, mientras que esta es rara de manera aislada4. Es más frecuente en hombres con estadios avanzados de la enfermedad. Esta espondilitis es menos sintomática que la espondilitis anquilosante y limita menos la movilidad de la columna vertebral. La afectación de las articulaciones sacroilíacas suele ser unilateral24.
Aparte de las lesiones cutáneas, otras manifestaciones extraarticulares de la artritis psoriásica son la uveítis, la conjuntivitis24 y la afectación subclínica del intestino25.
Se ha visto que la artritis psoriásica tiene una evolución semejante a la de la artritis reumatoide, con destrucción y pérdida de la función articular. Su tratamiento temprano puede frenar esta evolución21.
Figura 11. Artritis psoriásica
Fuente: Wikipedia (autor: James Heilman, MD)
Enfermedades cardiovasculares
Las enfermedades cardiovasculares son la causa principal de muerte de los pacientes con psoriasis. Los pacientes con psoriasis grave tienen un riesgo aproximadamente 7 veces mayor de sufrir infarto de miocardio4.
El riesgo de otras enfermedades arterioescleróticas, como el ictus y la enfermedad vascular periférica, también es mayor en los pacientes con psoriasis2.
La asociación entre la psoriasis y las enfermedades cardiovasculares se ha visto de forma más sistemática en los pacientes con psoriasis grave2,4
No se conoce el mecanismo exacto de su asociación, pero se ha visto que pueden estar implicados mediadores de la inflamación, que también participan en el desarrollo de la arterioesclerosis y de otros factores de riesgo cardiovascular4,21.
Por otro lado, muchos de los factores de riesgo cardiovascular ―como la diabetes mellitus, la hipertensión arterial, el síndrome metabólico y el consumo de tabaco― son más frecuentes en los pacientes con psoriasis. Además, algunos fármacos utilizados para tratar la psoriasis pueden llevar al desarrollo de estas comorbilidades; por ejemplo, la acitretina puede aumentar la lipidemia21.
En cuanto a los factores de riesgo cardiovascular, la psoriasis se asocia a los siguientes:
Síndrome metabólico. Es la suma de varios trastornos que se asocian a un aumento del riesgo de diabetes mellitus de tipo 2 y de enfermedades cardiovasculares: dislipemia, hipertensión, resistencia a insulina o diabetes establecida, obesidad central y exacerbación de la inflamación y la trombosis2,21. La concomitancia de estas alteraciones metabólicas es más frecuente de lo que se esperaría por mera casualidad y su agrupación añade riesgo cardiovascular más allá del que aporta cada uno de los factores por separado21.
La prevalencia del síndrome metabólico está aumentada en personas con psoriasis; varía entre el 14,3 % y el 50 %22 y es más frecuente en los casos más graves21 y en los pacientes con artritis psoriásica26.
Obesidad. La obesidad aumenta el riesgo de diabetes, enfermedad cardiovascular e, incluso, ciertos tipos de cáncer. En la mayoría de los estudios clínicos, se encuentra una asociación significativa entre psoriasis y obesidad, incluso entre psoriasis y sobrepeso. El riesgo aumenta con la gravedad de la psoriasis21.
Perder peso podría mejorar la psoriasis, aunque las pruebas científicas que lo avalan son limitadas2,22,27.
Por otra parte, es posible que la obesidad disminuya la eficacia de algunos tratamientos sistémicos2. A su vez, el tratamiento con inhibidores del factor de necrosis tumoral α (TNF α) (adalimumab, etanercept e infliximab) parece asociarse a un incremento del índice de masa corporal, lo cual debe tenerse en cuenta a la hora de tratar y hacer el seguimiento a estos pacientes21,28. Por el contrario, no se ha encontrado evidencia de que los anti-IL 12/23 y los anti-IL 17 aumenten el peso28.
Diabetes mellitus. La prevalencia de diabetes es mayor en los pacientes con psoriasis, y aumenta con la gravedad de esta2 (en pacientes con psoriasis grave, llega hasta un 41,9 %)21. El adalimumab puede causar hiperglucemia, hecho que debe valorarse en estos pacientes21.
Hipertensión. La prevalencia de hipertensión en los pacientes con psoriasis oscila entre el 8,9 % y el 44,4 % (60 % en ancianos). Al igual que ocurre con otras comorbilidades, la prevalencia se correlaciona con la gravedad de la psoriasis21.
La ciclosporina y el adalimumab pueden elevar la presión arterial21. A su vez, es posible que algunos fármacos antihipertensivos ―inhibidores de la enzima convertidora de angiotensina, bloqueantes β, antagonistas de los canales de calcio y diuréticos tiacídicos― agraven las lesiones o desencadenen brotes en pacientes con psoriasis21,29.
Dislipemia. La prevalencia de la dislipemia en los pacientes con psoriasis varía entre el 6,4 % y el 50,9 %21.
Tabaco y alcohol. Como ya se ha comentado, ambos son factores de riesgo de la psoriasis21.
Enfermedades autoinmunes
Se ha encontrado una asociación entre la psoriasis y varias enfermedades autoinmunes: alopecia areata, enfermedad celíaca, esclerosis sistémica, enfermedad de Crohn, colitis ulcerosa y vitíligo2.
Los pacientes con psoriasis tienen mayor riesgo de enfermedad de Crohn (riesgo relativo 2,53) y colitis ulcerosa (riesgo relativo 1,71)30.
Enfermedad del hígado graso no alcohólico
Se considera que existe enfermedad del hígado graso no alcohólico (EHGNA) cuando hay un depósito de triglicéridos en más del 5 % de los hepatocitos, sin antecedentes de consumo abusivo de alcohol21,31. Esta patología incluye un espectro de alteraciones que van desde el hígado graso, relativamente benigno, a la esteatohepatitis no alcohólica, que puede llevar a fibrosis, cirrosis y, raramente, carcinoma hepatocelular2.
Los pacientes con psoriasis tienen mayor riesgo de EHGNA: la prevalencia de EHGNA en estos pacientes es más del doble que en la población general32. Esto puede tener implicaciones en el tratamiento de la psoriasis, ya que algunos fármacos —como el metotrexato— pueden ser hepatotóxicos2.
Cáncer
Los pacientes con psoriasis tienen mayor riesgo de sufrir cáncer, sobre todo, linfoma y cáncer cutáneo diferente del melanoma, como el carcinoma basocelular y el carcinoma de células escamosas2,21,33. Otros tipos de cáncer, como el de pulmón y el de páncreas, también parecen ser más frecuentes2.
El riesgo de que los pacientes con psoriasis desarrollen linfomas puede atribuirse a la fisiopatología (a una respuesta inmunitaria anormal caracterizada por una mayor actividad de los linfocitos T y B y de las células presentadoras de antígenos) o al tratamiento de la psoriasis (el tratamiento de la psoriasis con ciclosporina o metotrexato se han relacionado con el desarrollo de linfoma)21.
En cuanto al riesgo de cáncer cutáneo, con excepción de la fototerapia con psolarenos y rayos ultravioleta A (PUVA) ―que se han relacionado con un riesgo aumentado de cáncer de piel (en particular, de carcinoma de células escamosas)―, no se ha establecido una relación definitiva entre la fototerapia y el cáncer de piel2.
Ansiedad y depresión
La psoriasis puede afectar a todas las facetas de la calidad de vida (trabajo, familia, relaciones sexuales, bienestar emocional, etc.). La visibilidad de las lesiones psoriásicas puede provocar el rechazo social y una sensación de estigmatización en los pacientes21.
Se han descrito tasas elevadas de diversas psicopatologías, como baja autoestima, disfunción sexual, ansiedad, depresión e ideación suicida2.
Los trastornos psicosociales no vienen determinados por la gravedad de la psoriasis. Pacientes con psoriasis leve pueden sufrir gran estrés emocional debido a la enfermedad2,21.
Algunos estudios han encontrado una prevalencia de depresión en los pacientes con psoriasis de hasta el 62 %, aunque con una amplia variabilidad. La ansiedad asciende incluso hasta el 43 %21 y la ideación suicida al 5 %2.
Otras enfermedades
Otras enfermedades que podrían también ser más prevalentes en los pacientes con psoriasis son la insuficiencia renal crónica, las arritmias cardíacas, la enfermedad pulmonar obstructiva crónica, la apnea obstructiva del sueño, la osteoporosis, el parkinsonismo y la migraña2.
Psoriasis y COVID
La relación entre la psoriasis ―sobre todo la moderada y grave― y el COVID-19 tiene importancia porque estos pacientes pueden tener comorbilidades (hipertensión, diabetes, obesidad) que se asocian a mayor gravedad del COVID34. La psoriasis por sí sola (sin comorbilidades) no parece relacionarse con mayor riesgo de COVID grave35.
En cuanto a si la infección por COVID empeora la psoriasis, en una revisión sistemática se encontraron 9 casos de exacerbaciones de psoriasis tras la infección; no obstante, la mayoría podrían deberse al uso de hidroxicloroquina o corticoesteroides sistémicos o a la interrupción del tratamiento de la psoriasis36. Asimismo, se han reportado casos de brotes y de psoriasis pustulosa de nueva aparición tras la infección por SARS-CoV-2. Aunque estos datos no son suficientes para demostrar que el COVID empeore el curso de la psoriasis o desencadene su aparición de novo, tampoco puede descartarse, más aún teniendo en cuenta que las infecciones víricas son un desencadenante conocido de la psoriasis37.
Por otro lado, al principio de la pandemia se dudó de la conveniencia del tratamiento inmunosupresor en los pacientes con COVID y psoriasis, por el posible efecto perjudicial de la inmunosupresión en la infección por el SARS-CoV-2.
No obstante, varios estudios han mostrado que los pacientes con psoriasis en tratamiento sistémico o biológico tienen la misma o incluso menos incidencia de COVID34,37.
Por ejemplo, un metanálisis encontró que la tasa de hospitalización y la tasa de letalidad era menor en pacientes con psoriasis en tratamiento sistémico o biológico que en pacientes sin él; este posible efecto protector fue más marcado en el tratamiento con biológicos34.
Asimismo, en una revisión sistemática de reporte de casos se describen casos tanto de psoriasis de nueva aparición como de brotes tras la aplicación de vacunas anti-COVID38. A pesar de esto, la vacunación sigue representando la medida más efectiva para prevenir las formas graves de COVID-19 en pacientes con psoriasis, por lo que se recomienda que los pacientes se vacunen. Dado que la evidencia científica sugiere que es posible que los inmunosupresores disminuyan la respuesta inmunitaria a la vacuna, es preferible vacunar antes de empezar el tratamiento. No obstante, si el paciente ya está con él, no se aconseja suspenderlo37.
Diagnóstico
¿Cómo se diagnostica la psoriasis?
El diagnóstico de psoriasis es casi siempre clínico. La biopsia cutánea ayuda en los casos dudosos, pero no suele ser necesaria1.
La historia clínica debe incluir información acerca de los miembros de la familia afectados por la enfermedad y de los posibles factores desencadenantes, tales como infecciones o el uso de nuevos medicamentos1.
Aparte de una exploración física exhaustiva de la piel, incluida la región anogenital y las uñas, debe investigarse de rutina la posible presencia de artritis psoriásica, para detectarla lo antes posible1,39. Esto incluye preguntar por dolor y rigidez articular, así como por dolor de espalda1.
Además, debe evaluarse la presencia de comorbilidades, incluidos los factores de riesgo de enfermedad cardiovascular y los trastornos psicológicos2. Esto es especialmente importante en los casos de psoriasis grave9.
La evaluación de los factores de riesgo cardiovascular incluye indagar sobre el tabaquismo y medir la tensión arterial, la hemoglobina A1c, el perfil lipídico, el IMC y la circunferencia abdominal39.
En TODAS las personas con psoriasis, se debe evaluar40:
- La gravedad de la enfermedad.
- La repercusión en el bienestar físico, psicológico y social.
- La presencia de artritis psoriásica.
- La presencia de otras comorbilidades.
¿Cuál es el diagnóstico diferencial?
Las patologías con las cuales es preciso hacer el diagnóstico diferencial dependen de la presentación de la psoriasis. En el caso de la psoriasis en placas, las que con más frecuencia se confunden son las siguientes (Cuadro 3):
- Dermatitis seborreica. Sospechamos una dermatitis seborreica porque las escamas son más finas y grasientas (Figura 12) y es típico que afecte a las cejas, los pliegues nasolabiales, el pecho y el área retroauricular (otras localizaciones, como el cuero cabelludo, las orejas o las áreas intertriginosas, son habituales tanto en la dermatitis seborreica como en la psoriasis) (Figura 13). La afectación ungueal y de otras zonas diferentes de la cara apoyan el diagnóstico de psoriasis1.
Figura 12. Dermatitis seborreica
Fuente: Wikipedia (autor: Roymishali)
Figura 13. Localizaciones típicas de la dermatitis seborreica
- Dermatitis atópica. La descamación es fina y superficial y las lesiones muy pruriginosas. En niños mayores y adultos afecta típicamente a las flexuras, aunque en niños más pequeños afecta a las mejillas y a las zonas de extensión de los miembros. Al contrario que la psoriasis, la dermatitis atópica respeta el área del pañal1.
- Pitiriasis rosada de Gibert. Las escamas son más finas y furfuráceas. La enfermedad suele comenzar por una lesión anular más grande que las otras18 (Figura 14).
- Liquen simple crónico. Este término describe cambios de la piel secundarios al rascado excesivo. Por tanto, suele haber una causa del rascado (dermatitis atópica, etc.); de hecho, puede coexistir con la psoriasis si esta es muy pruriginosa. Las zonas donde el paciente no puede rascarse no están afectadas. Las lesiones son placas de piel engrosada con los pliegues naturales de la piel muy marcados, a veces con descamación e hiperpigmentación1.
- Eccema numular. Placas bien delimitadas, redondeadas, de 1 a 10 cm de diámetro, por lo general eritematosas, con descamación, costras o pequeñas fisuras. Al contrario que en la psoriasis, los bordes están mal definidos. Suele afectar al tronco y las extremidades, y respeta la cara y el cuero cabelludo1.
- Micosis. Las infecciones micóticas superficiales pueden presentarse como placas eritematosas que pueden confundirse con psoriasis. La preparación con hidróxido de potasio (KOH) o la biopsia pueden confirmar la infección fúngica1.
Figura 14. Pitiriasis rosada de Gibert
Cuadro 3. Diagnóstico diferencial de la psoriasis en placas
|
Fuente: elaboración propia a partir de Feldman1 y de Du-Than y otros18
¿Cómo se evalúa la gravedad de la psoriasis?
El tipo de tratamiento más apropiado se establece en función de la gravedad de la psoriasis. Por eso, en todos los pacientes con psoriasis es fundamental valorar la gravedad de la enfermedad40.
La gravedad de la psoriasis debe determinarse40:
- en la primera visita;
- antes de derivar al especialista;
- para valorar la eficacia del tratamiento.
Índices de medición de la gravedad de la psoriasis
La clasificación de la psoriasis según su gravedad se logra utilizando diversas herramientas de medición.
Área de superficie corporal (Body Surface Area, BSA)
Este método valora el porcentaje de superficie corporal afectada por la psoriasis41.
La forma más sencilla es usar la palma de la mano del paciente (incluidos los dedos) como equivalente al 1 % de toda la superficie corporal41. Para superficies amplias, la regla del 9 de Wallace ―usada para evaluar la superficie afectada en pacientes con quemaduras― puede ayudar a calcular más rápido el BSA en adultos42 (no es válida para niños)43 (Tabla 1).
Tabla 1. Cálculo del BSA
| Regla del 1 % o de la palma de la mano | Regla del 9 de Wallace |
| La palma de la mano del paciente, con los dedos extendidos y juntos, representa el 1% de la superficie corporal total |
|
| Válida en adultos y niños a partir de 1 año | Válida solo en adultos |
Fuente: Martin y otros42 y Cabanela López y otros43
Índice de intensidad y extensión de la psoriasis (Psoriasis Area Severity Index, PASI)
El PASI es el estándar de referencia para evaluar la gravedad de la psoriasis40. Sin embargo, es una medida compleja42. Otras desventajas son que tiene poca sensibilidad para valorar los cambios cuando la superficie afectada es <10 %40, tiene escasa correlación con los síntomas y la calidad de vida del paciente44 y no evalúa áreas especiales o de difícil manejo45. Por su parte, la Academia Española de Dermatología y Venereología (AEDV) indica que los principales problemas del PASI son la dependencia de la subjetividad del médico, que puede dar lugar a diferentes valores en un mismo paciente cuando la medición la realizan distintos médicos; la falta de inclusión de los síntomas que produce la enfermedad; su falta de utilidad en formas como la pustulosa; y que la sensibilidad de la escala es menor en los valores bajos y no guarda proporcionalidad41.
El PASI evalúa las lesiones de psoriasis en cuatro localizaciones: cabeza (incluye cuello), extremidades superiores, tronco y extremidades inferiores (incluyen glúteos y genitales). En cada área, se valoran dos aspectos40,44:
- Intensidad de las lesiones: se toma en cuenta el grado de eritema, de descamación y de induración; a cada una de estas características se le asigna una intensidad de 0 (ninguno) a 4 (muy intenso). La intensidad total de las lesiones en cada área corporal evaluada varía, por tanto, de 0 a 12.
- Extensión de las lesiones: se le asigna un valor de 0 a 6, según el porcentaje de superficie corporal comprometida:
- 1 punto (<10 %)
- 2 puntos (10 % a 29 %)
- 3 puntos (30 % a 49 %)
- 4 puntos (50 % a 69 %)
- 5 puntos (70 % a 89 %)
- 6 puntos (90 % a 100 %)
Estos parámetros se combinan mediante una fórmula matemática previamente definida: la puntuación subtotal de la intensidad de cada área del cuerpo se multiplica por la puntuación de la extensión en esa área, y el resultado se multiplica por un valor ponderado de 0,1, 0,2, 0,3 y 0,4 para la cabeza, los brazos, el tronco y las piernas, respectivamente. El PASI total es la suma del PASI de cada área, y varía entre 0 y 7240,44.
El PASI se aplica solo a la psoriasis en placas, dadas las características que evalúa, y no está validado en niños40.
La determinación del PASI de un paciente en un momento concreto se denomina PASI absoluto. Además, para valorar la eficacia y la respuesta al tratamiento se usan también los índices de eficacia PASI 50, PASI 75, PASI 90 y PASI 10041,45.
El PASI 50 es el valor PASI que representa el 50 % del PASI basal de un paciente; es decir, que un paciente alcance un PASI 50 supone que su PASI actual es, al menos, un 50 % menor que su PASI basal. De igual forma, el PASI 75 supone la disminución del 75 % del PASI basal; el PASI 90, la disminución del 90 % respecto del PASI basal, y el PASI 100, la remisión completa de las placas de psoriasis41.
Ejemplo: un paciente con un PASI = 20 al inicio, alcanzaría el PASI 50 cuando su PASI fuera igual o inferior a 10; alcanzaría su PASI 75 cuando el PASI fuera igual o inferior a 5, y alcanzaría su PASI 90 cuando su PASI fuera igual o inferior a 241.
Evaluación global del médico (Physician Global Assessment, PGA)
Es un instrumento de medida que proporciona una evaluación subjetiva por parte del médico de la gravedad de la enfermedad en función de la intensidad de las lesiones. No valora ni la extensión ni la localización individual de las lesiones, sino que se da una puntuación promedio de la intensidad de todas las lesiones. Por consiguiente, es válido tanto para formas extensas como localizadas de psoriasis41.
Por lo general, el PGA estático tiene una puntuación comprendida entre el 0 y el 641:
- 0 puntos: lesión blanqueada.
- 1 punto: lesión casi blanqueada, mínima.
- 2 puntos: intensidad leve.
- 3 puntos: intensidad de leve a moderada (infiltración leve, eritema y descamación moderadas).
- 4 puntos: intensidad moderada.
- 5 puntos: intensidad de moderada a grave (infiltración, eritema o descamación marcadas).
- 6 puntos: intensidad grave.
El PGA tiene las desventajas de que es subjetivo y poco sensible a los cambios en los pacientes con puntuaciones intermedias. La principal ventaja es su sencillez41.
El PGA dinámico sirve para valorar la evolución de la enfermedad respecto de la situación basal, y tiene como principal inconveniente que cada observador debe ser capaz de recordar la situación basal de cada paciente. Se valora como sigue41:
- +5: blanqueamiento o mejoría entre el 90 % y el 100 %.
- +4: mejoría importante, entre el 70 % y el 90 %.
- +3: mejoría de moderada a importante, entre el 50 % y el 70 %.
- +2: mejoría moderada, entre el 30 % y el 50 %.
- +1: mejoría leve, entre el 10 % y el 30 %.
- 0: sin cambios o cambios mínimos respecto de la situación basal.
- -1: empeoramiento leve.
- -2: empeoramiento moderado.
- -3: empeoramiento de moderado a importante.
- -4: empeoramiento importante.
- -5: empeoramiento muy importante.
Índice de calidad de vida en dermatología (Dermatology Life Quality Index, DLQI)
Se trata de un cuestionario rellenado por el paciente, corto, sencillo y fácil de usar, que se emplea para evaluar la calidad de vida en relación con la salud en adultos que padecen enfermedades cutáneas46. Es el instrumento más utilizado para medir la calidad de vida de los pacientes con psoriasis45.
El cuestionario consta de 10 preguntas relacionadas con la percepción que tiene el paciente de la repercusión de la psoriasis en diferentes aspectos de su vida en los últimos 7 días. El cuestionario evalúa diferentes dimensiones, como síntomas y sentimientos, actividades diarias, ocio, trabajo o estudios, relaciones personales y efectos adversos del tratamiento46.
Cada pregunta se puntúa de 0 a 3, donde 0 equivale a «nada en absoluto» y 3 significa «muchísimo». La puntuación total varía entre 0 y 30. A mayor puntuación, mayor deterioro de la calidad de vida46.
Nail Psoriasis Severity Index (NAPSI)
Es un instrumento de medida específico de la afectación ungueal. Para calcularlo, cada uña se divide en 4 cuadrantes imaginarios y se buscan signos de afectación de la matriz ungueal o del lecho (Figura 15)41:
- Matriz ungueal: se evalúa si hay traquioniquia (aumento de las estriaciones longitudinales), lúnula roja, leuconiquia (coloración blanquecina de la uña) y pitting. Se puntúa de 0 a 4 en función del número de cuadrantes afectos.
- Lecho ungueal: se valora si hay onicólisis (separación distal de la uña de su lecho), hiperqueratosis subungueal, hemorragias en astilla o manchas de aceite. Al igual que en el caso anterior, se puntúa entre 0 y 4 según el número de cuadrantes afectos.
Como cada uña puede tener afectada como máximo la matriz y el lecho de los cuatro cuadrantes, el máximo NAPSI es de 80 si se evalúan sólo las manos y de 160 si se evalúan también las uñas de los pies41.
Figura 15. Signos de psoriasis ungueal (uña del primer dedo del pie)
En todos estos métodos de evaluación de la gravedad, cuanto mayor es la puntuación, mayor es la gravedad de la psoriasis.
¿Qué índices es mejor utilizar?
Las guías clínicas recomiendan evaluar tanto la gravedad de las lesiones como su repercusión en la calidad de vida del paciente40,44,45,47–51. Sin embargo, no existe consenso sobre qué índices utilizar.
Evaluación de la gravedad en la práctica clínica. Las guías europeas más recientes describen los diferentes índices, pero no recomiendan ninguno en específico y aconsejan a las sociedades nacionales definir y usar las herramientas de gradación de la gravedad que consideren apropiadas en función de sus características locales51.
Por su parte, en su reciente actualización práctica de las recomendaciones para el tratamiento de la psoriasis con terapia biológica, el Grupo de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología considera que el PASI absoluto es más útil que el PASI relativo como medida de actividad para establecer el objetivo terapéutico y la respuesta al tratamiento en la práctica clínica, ya que resulta independiente del PASI basal. También dice que el DLQI, el BSA y el PGA pueden usarse además del PASI para tomar decisiones terapéuticas, y explica que el BSA siempre debe calcularse si se evalúa el PGA45. En un documento anterior, la AEDV explica que un paciente con un PASI bajo, pero con un BSA alto, tendría una forma extensa de psoriasis con eritema, descamación e infiltración discretos; al revés, un BSA bajo con un PASI elevado nos indicaría una enfermedad con placas gruesas, eritematosas y muy descamativas, pero localizadas41.
Por su parte, el National Institute for Health and Clinical Excellence (NICE) diferencia entre atención especializada y atención no especializada. En la atención especializada recomienda el PASI, en adición al BSA y el PGA. No obstante, en atención no especializada recomienda hacer el PGA y el BSA40. Otros autores también recomiendan el BSA en atención primaria52,53.
En atención primaria, los índices más adecuados para evaluar la gravedad de las lesiones son el BSA40,52,53 y el PGA40.
Con independencia de las recomendaciones de las guías, en general, el PGA y el BSA se utilizan en la práctica clínica habitual, ya que son más fáciles de usar, mientras que el PASI se limita generalmente al entorno de los ensayos clínicos4,54. Por ejemplo, en Estados Unidos, lo más frecuente en la práctica clínica es utilizar el BSA para evaluar la gravedad y establecer los objetivos del tratamiento42,54.
Se use el que se use, para completar la evaluación debe valorarse también si existe afectación de zonas especiales, bien por su mayor impacto en la calidad de vida, bien por ser de difícil manejo40,44,45 (Cuadro 4).
Además, en atención especializada debe usarse el NAPSI para valorar la gravedad de la afectación ungueal40,45 si existe una repercusión cosmética o funcional importante, así como antes y después de empezar con un tratamiento específico para la psoriasis de las uñas40.
Cuadro 4. Áreas de gran repercusión y/o difícil tratamiento
|
Fuente: Daudén y otros55 y Carrascosa y otros45
Evaluación del impacto de la psoriasis en la calidad de vida del paciente. Para esto, el instrumento más recomendado es el DLQI44,45,50,55.
El NICE recomienda utilizar el DLQI en atención especializada, mientras que en la no especializada aconseja evaluar siempre la repercusión de la psoriasis en el bienestar físico, psicológico y social, pero aplicar el DLQI solo si es factible40.
Para evaluar la gravedad de la psoriasis se deben combinar uno o más índices que valoren la intensidad y/o extensión de las lesiones (PASI, BSA, PGA), más una valoración del impacto en la calidad de vida (DLQI), más la evaluación de la afectación de zonas especiales40,45,51,55 .
Cómo se clasifica la psoriasis en función de la gravedad?
La AEDV45,55, así como otras guías y consensos47,56, clasifican la enfermedad en dos categorías: psoriasis leve y psoriasis de moderada a grave. Los criterios que definen la psoriasis de moderada a grave se muestran en el Cuadro 5.
Cuadro 5. Criterios para definir la psoriasis de moderada a grave
|
CUALQUIERA de los siguientes:
|
BSA: área de superficie corporal; DLQI: índice de calidad de vida en dermatología; PASI: índice de intensidad y extensión de la psoriasis.
*Se considera psoriasis grave.
Fuente: Daudén y otros55 y Carrascosa y otros45
En los pacientes con psoriasis de moderada a grave, está indicado el tratamiento sistémico55.
Sin embargo, existen también otros criterios para definir la gravedad. Por ejemplo, la Academia Americana de Dermatología define la psoriasis como leve cuando el BSA es <3 %; como moderada, cuando el BSA está entre el 3 % y el 10 %; y como grave, cuando el BSA es >10 %. Considera que la psoriasis puede ser grave, con independencia del valor del BSA, cuando tiene importantes repercusiones emocionales, afecta a áreas especiales o provoca prurito intratable57.
En 2020, el International Psoriasis Council propuso una nueva clasificación de la gravedad de la psoriasis: en lugar de las categorías leve, moderada y grave, abogó por clasificar a los pacientes en candidatos a tratamiento tópico y candidatos a tratamiento sistémico. Los candidatos a tratamiento sistémico deben cumplir, al menos, uno de los siguientes criterios58:
- BSA >10 %;
- afectación de áreas especiales;
- fracaso del tratamiento tópico.
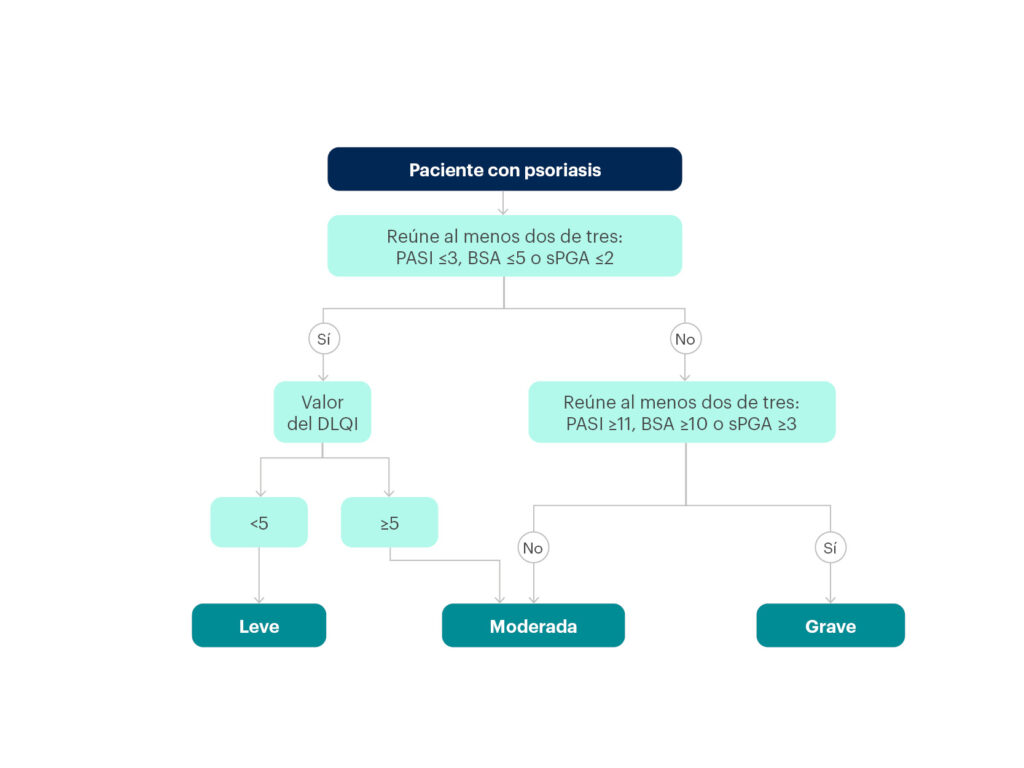
Más recientemente aún (2021), un grupo de autores españoles ha propuesto un modelo de clasificación de la gravedad de la psoriasis que tiene en cuenta el PASI, el BSA, el PGA estático y el DLQI (figura 16)59:
- La clasificación de psoriasis grave se hace en un solo paso y corresponde a aquella que reúna dos de los tres siguientes: PASI ≥11, BSA ≥10 o sPGA ≥3.
- La definición de psoriasis leve se hace en dos pasos y corresponde a pacientes que cumplen dos de tres (PASI ≤3, BSA ≤5 o sPGA ≤2) y además tienen un DLQI <5.
- La definición de psoriasis moderada se hace en dos pasos y corresponde a pacientes que no cumplen dos de los tres criterios de psoriasis grave (PASI ≥11, BSA ≥10 o sPGA ≥3), pero tienen un DLQI ≥5.
Figura 16. Algoritmo clínico para la clasificación de la gravedad de la psoriasis, según un grupo de autores españoles
¿Cuándo derivar de atención primaria a dermatología?
Los criterios de derivación a dermatología se muestran en el Cuadro 6.
Cuadro 6. Criterios de derivación de atención primaria a dermatología
|
Fuente: NICE40, Lim y otros52, y Ballester Torrens y otros53
Tratamiento
¿Cuál es el tratamiento de la psoriasis?
No existe tratamiento curativo de la psoriasis. El objetivo, por tanto, es hacer desaparecer el máximo de lesiones cutáneas y mantener el resultado con los menores efectos secundarios posibles19.
Podemos dividir el tratamiento en no farmacológico (adecuado para todos los tipos de psoriasis) y farmacológico. Dentro del segundo, a su vez, distinguimos entre tratamiento tópico, fototerapia y tratamiento sistémico (con medicamentos clásicos o con medicamentos biológicos). Escoger uno u otro dependerá de la gravedad de la psoriasis, las enfermedades concomitantes, la respuesta a tratamientos previos y las expectativas del paciente4,18,42. Estos tratamientos pueden usarse en monoterapia o combinados4,60.
Tratamiento no farmacológico
Emolientes e hidratantes (vaselinas, glicerina, ácido hialurónico, urea). No son suficientes como monoterapia, pero sí como coadyuvantes, para disminuir la sequedad y descamación de la piel y aliviar el prurito60,61. Deben aplicarse después del baño, con la piel algo húmeda, para que penetren mejor60,62. No deben aplicarse en los pliegues, por el riesgo de maceración63.
Medidas higiénico-dietéticas. Los cuidados de la piel con psoriasis pueden verse en el Cuadro 7.
Además, se recomienda:
- Perder peso, si existe sobrepeso u obesidad2,60,64.
- Dieta: se aconseja una dieta sin gluten en pacientes con psoriasis y enfermedad celíaca confirmada64. Por otro lado, aunque los estudios son insuficientes para confirmar el efecto beneficioso de la dieta mediterránea, hay datos que lo sugieren60.
- No fumar ni beber alcohol2,60.
Cuadro 7. Recomendaciones higiénico-cosméticas para los pacientes con psoriasis
|
Fuente: Palomar Llatas62
Tratamiento tópico
Los medicamentos tópicos suelen ser adecuados para pacientes con un grado leve de psoriasis4,9,60. Alrededor del 70 %-80 % de los pacientes tienen formas leves de psoriasis9.
Además, para las psoriasis más graves, que requieren tratamiento sistémico, los medicamentos tópicos pueden ser una terapia complementaria para aumentar la eficacia de los medicamentos sistémicos en algunas localizaciones, para disminuir la dosis o para combatir una recidiva pasajera. También tienen una indicación fundamental en áreas específicas, como el cuero cabelludo y los pliegues18,60,61,65.
Los pacientes con psoriasis leve pueden tratarse inicialmente en atención primaria con medicamentos tópicos. Si la respuesta no es adecuada, deben derivarse a dermatología52,60,63.
Corticoesteroides
Los corticosteroides siguen siendo el pilar principal de la terapia tópica para la psoriasis60. Escoger el más adecuado depende de diversos factores, como la potencia (que depende de la vasoconstricción que producen en la piel, así como de la concentración y el vehículo) (Tabla 2) y la zona del cuerpo afectada66.
Tabla 2. Clasificación de los corticoides tópicos según su potencia, concentración y vehículo
| Potencia | Principio activo | Vehículo |
| Grupo I.
Potencia baja |
Hidrocortisona | crema (5 mg/g), espuma (5 mg/g), pomada (10 mg/g), emulsión (10 mg/ml) |
| Grupo II.
Potencia moderada |
Clobetasona | Crema (0,5 mg/g) |
| Buteprato de hidrocortisona | Crema (1 mg/g) | |
| Triamcinolona | Emulsión (1, 2 y 6 mg/g), pomada (1 mg/g) | |
| Grupo III.
Potencia alta |
Beclometasona | Crema (0,25 mg/g), emulsión (0,25 mg/g), ungüento (0,25 mg/g) |
| Betametasona | Crema (0,5, 1 y 5 mg/g), pomada (0,5 y 5 mg/g), solución (0,5 y 1 mg/g), emulsión cutánea (1 mg/g), emulsión tópica (2 mg/g) | |
| Diflorasona | Gel (0,5 mg/g) | |
| Diflucortolona | Crema (1 mg/g) | |
| Acetónido de fluocinolona | Crema (0,1, 0,25 y 2 mg/g), espuma (0,25 mg/g), gel (0,25 mg/g) | |
| Fluocinonida | Crema (0,5 mg/g) | |
| Fluticasona | Crema (0,5 mg/g) | |
| Aceponato de hidrocortisona | Crema (1,27 mg/g), pomada (1,27 mg/g) | |
| Aceponato de metilprednisolona | Crema (1 mg/g), emulsión (1 mg/g), pomada (1 mg/g), solución (1 mg/g), ungüento (1 mg/g) | |
| Mometasona | Crema (1 mg/g), emulsión (1 mg/g), pomada (1 mg/g), solución (1 mg/ml) | |
| Prednicarbato | Crema (2,5 mg/g), pomada (2,5 mg/g), solución (2,5 mg/g), ungüento (2,5 mg/g) | |
| Grupo IV.
Potencia muy alta |
Clobetasol | Crema (0,5 mg/g), espuma (500 µg/g), champú (500 µg/g), pomada (500 µg/g), solución (500 µg/ml) |
Fuente: adaptado de Sabaté y otros67
Los vehículos disponibles son los siguientes:
- Ungüentos y pomadas. Son los más oclusivos y aumentan la absorción de los medicamentos. Poco aceptados cosméticamente, pues resultan grasientos y pegajosos. Son adecuados para tratar placas hiperqueratósicas gruesas y en lesiones liquenificadas. No se recomienda usarlos en pliegues, áreas vellosas ni intertriginosas ni en lesiones húmedas, ya que pueden causar maceración y foliculitis. Los ungüentos serían más adecuados para palmas y plantas y las pomadas para tronco y extremidades66,67.
- Cremas. Se absorben bien y cosméticamente se aceptan mejor que los ungüentos y pomadas. Son útiles para áreas intertriginosas y lesiones exudativas, así como para zonas de piel fina de la cara, pliegues, escroto y piel con vello66,67. Existe una nueva formulación acuosa, basada en la novedosa tecnología PAD, disponible para la combinación de betametasona y calcipotriol. Esta nueva crema presenta mayor eficacia y aceptación por el paciente que la misma combinación en gel68,69.
- Lociones. Son útiles para superficies corporales grandes y para el cuero cabelludo y la piel pilosa67. Están disponibles en:
- Emulsiones: mezcla de una fase acuosa, una oleosa y un emulgente67.
- Soluciones: preparados líquidos con el principio activo disuelto en alcohol, agua, propilenglicol o polietilenglicol. Tienden a secar la piel, más que a hidratarla67.
- Geles: son emulsiones de aceite en agua con alcohol en la base que se licua al contacto con la piel y que se secan en una película delgada no oclusiva (sin grasa). Presentan las mejores características cosméticas y de aceptabilidad67 (aunque, como hemos dicho, la crema basada en la tecnología PAD presenta mayor aceptación por el paciente68,69, pero no está disponible para el corticoide solo).
- Aerosoles, espumas y champús: los aerosoles y las espumas contienen los corticoesteroides en solución con un gas propelente. Los tres son de fácil aplicación y se utilizan principalmente en zonas con vello67.
Los vehículos grasos, por sus características oclusivas, se absorben más y resultan más potentes. El orden de potencia es el siguiente:
ungüento > pomada > crema > gel > loción > aerosol66,67
En cuanto a la elección del corticoide según la localización, en general, se recomienda lo siguiente:
- Tronco y miembros: para las placas gruesas, suelen ser necesarios corticoides de potencia alta o muy alta60,61,66, como la betametasona al 0,05 % o el propionato de clobetasol al 0,05 %60. En palmas, plantas, codos y rodillas pueden ser necesarios ungüentos66.
- Cuero cabelludo y oído externo: están indicados los corticoides de potencia alta en solución, gel, espuma60,66.
- Cara, pliegues y genitales: corticoides de baja40,60,66 o moderada potencia40.
La pauta típica consiste en 1 o 2 veces al día40,63,65; 1 vez al día suele ser suficiente67,70. Deben aplicarse en capa fina. Las cremas, pomadas y ungüentos deben frotarse hasta que desaparezcan67.
Se recomienda aplicar el corticoesteroide hasta que el resultado sea satisfactorio (resolución completa o casi completa del brote)40,66. Los corticoides de potencia muy alta no deben aplicarse más de 4 semanas seguidas, y los de potencia alta, no más de 8 semanas. Entre ciclos deben pasar, al menos, 4 semanas40.
Tras la mejoría del brote, opciones de pauta de mantenimiento pueden ser de 2 a 3 aplicaciones semanales63 (por ejemplo, los fines de semana)60,63. Otra posibilidad es utilizar para el mantenimiento tratamientos tópicos no corticoesteroideos o una combinación de corticoesteroides y análogos de la vitamina D (opción preferida por la mayoría de los expertos, guías y consensos)70,71.
Los efectos adversos de los corticoides tópicos aumentan con la potencia del corticoide. Los más frecuentes son los locales: atrofia del tejido cutáneo, estrías, telangiesctasia, erupción acneiforme, dermatitis de tipo rosácea, alteraciones de la pigmentación, hipertricosis… Los efectos sistémicos (hipofunción suprarrenal) son muy raros66,67.
La taquifilaxia se caracteriza por una disminución progresiva de la respuesta clínica debida al uso repetitivo y prolongado del corticoide. No se ha identificado claramente después de cuántas semanas de uso se presenta66,67, aunque hay autores que mencionan 12 semanas61.
Por otra parte, puede haber efecto rebote, que se evita retirando el medicamento de forma gradual. Para ello, se puede ir disminuyendo la potencia del corticoide, a la vez que se distancia el intervalo de aplicación61,63,66.
Análogos de la vitamina D
Los derivados de la vitamina D (calcipotriol, calcitriol y tacalcitol) actúan inhibiendo la proliferación de los queratinocitos. Son más efectivos y se toleran mejor cuando se combinan con corticoesteroides que cuando se usan en monoterapia. Además de para tratar los brotes, se usan como mantenimiento, para «ahorrar» corticoide60.
El efecto adverso más frecuente es la irritación. En los pliegues y la cara es preferible el calcitriol, ya que es menos irritativo. El riesgo de hipercalcemia es muy bajo cuando se usa de manera apropiada60.
Pueden usarse con fototerapia, pero deben aplicarse después, para evitar su inactivación por los rayos UVA y para que ellos no bloqueen los rayos UVB. No se debe combinar con ácido salicílico61.
Retinoides
Los retinoides tópicos (tazaroteno) en monoterapia presentan una eficacia limitada y son muy irritativos. Por eso, suelen usarse en combinación con corticoesteroides, ya que así aumenta la efectividad y se toleran mejor. Es un tratamiento de segunda línea63.
Inhibidores de la calcineurina
El tacrolimus y el pimecrolimus son efectivos (aunque menos que los corticoides) para tratar la psoriasis en áreas sensibles, como la cara, los pliegues y los genitales. Esto permite disminuir el uso de corticoides60. No obstante, en España no están aprobados para esta indicación72,73.
Otros
El ditranol ―también conocido como antralina― y los alquitranes de hulla se han utilizado tradicionalmente para tratar la psoriasis. Ambos son efectivos, pero poco aceptados por los pacientes, ya que manchan e irritan la piel. Por eso, en la actualidad prácticamente no se usan60,63.
Los queratolíticos, como el ácido salicílico y el ácido láctico, son útiles para eliminar las escamas y facilitar la penetración percutánea de algunos medicamentos. Se aplican 1 vez al día, no más de 6-8 horas seguidas, para evitar la irritación, maceración e infección63.
La FDA aprobó en 2022 la crema de roflumilast, el primer inhibidor selectivo de la fosfodiesterasa de tipo 4 tópico para el tratamiento de la psoriasis en placas, incluida la psoriasis en pliegues. Se aplica 1 vez al día60.
También aprobó la crema de tapinarof al 1 % para el tratamiento tópico de la psoriasis en placas. El tapinarof es un modulador de los receptores de hidrocarburos arílicos que actúa modulando las citocinas producidas por los linfocitos T cooperadores de tipo 17 (como la IL-17A y la IL-17F), normalizando la barrera cutánea y actuando como antioxidante. Se aplica 1 vez al día60.
Uno de los principales motivos del fracaso del tratamiento tópico es la adherencia. Una visita a la semana de comenzar el tratamiento puede mejorar la adherencia60.
¿Cuál es el tratamiento tópico de elección en la psoriasis leve?
Las guías clínicas no se ponen del todo de acuerdo en cuanto a la terapia tópica de elección65, aunque la más recomendada es la combinación fija de calcipotriol y betametasona63,74, ya que es más eficaz y se tolera mejor que el calcipotriol y la betametasona en monoterapia63,75 y, además, la combinación en dosis fija puede mejorar la adherencia70.
Las opciones de tratamiento tópico se exponen en la Tabla 3.
Tabla 3. Opciones de tratamiento tópico de la psoriasis leve
| Fármaco | Brote o exacerbación | Mantenimiento | Efectos adversos y observaciones |
| 1.ª línea | |||
| Combinación fija de corticoides y análogos de la vitamina D*40,63,74,75 | 1 v/d durante 4 sem63,74 | 1-2v/sem70,71,75,76 | Irritación, prurito ocasional63. |
| Corticoides
(Potencia en función de la localización) |
1-2 v/durante 3-4 sem63 | 1-3 v/sem63
|
Locales (atrofia, dermatitis, estrías, alteraciones de la pigmentación, etc.)66. Hipofunción suprarrenal (rara)66. |
| Análogos de la vitamina D63
Calcipotriol Tacalcitol Calcitriol |
2 v/d durante 4-8 sem61 | 1-3 v/sem63 | Irritación, hipercalcemia (rara). No administrar más de 100 g/sem de calcipotriol o 30 g/sem de tacalcitol.
No administrar en insuficiencia renal. No combinar con ácido salicílico. No aplicar en la cara ni en los pliegues (excepto el calcitriol)63. |
| 2.ª línea | |||
| Combinación de corticoides y ácido salicílico40 | 1-2 v/d durante 2-4 sem63 | No determinada63 | Indicados en lesiones hiperqueratósicas63.
Irritación, prurito63. |
| Retinoides
Tazaroteno63,74 |
1 aplicación por la noche durante un máximo de 3 meses63. | Irritación.
Se usan en combinación con corticoides63,74. |
|
| Reductores63
Alquitrán Ditranol |
1 v/d. Empezar por 30 min a días alternos y aumentar la duración y frecuencia según la tolerancia63 | Irritación.
Son difíciles de aplicar y manchan. Apenas se usan63. |
|
d: día; v: vez; sem: semana
*El calcipotriol con betametasona es la única combinación fija comercializada.
Fuente: elaboración propia a partir de las referencias.
Tratamiento tópico de elección según la zona a tratar
Tratamiento tópico de elección para tronco y miembros. Para la psoriasis de tronco y miembros, el NICE40 ―así como otros autores y guías44,74,75― propone empezar por un corticoesteroide de potencia alta junto con un análogo de la vitamina D, 1 vez al día, durante 4 semanas. Si en 4 semanas no hay una respuesta satisfactoria, se puede continuar 4 semanas más40,75.
La combinación de calcipotriol y betamesona es más eficaz y se tolera mejor que el calcipotriol y la betametasona en monoterapia63,75. La combinación en dosis fija puede mejorar la adherencia70.
La alternativa sería la monoterapia con un corticoesteroide de potencia alta o muy alta o un análogo de la vitamina D74,75.
Tratamiento tópico de elección para el cuero cabelludo. Tanto la combinación de calcipotriol con betametasona74,77 durante 4 a 12 semanas77 como un corticoesteroide potente 1 vez al día durante 4 semanas40,77 son opciones adecuadas y recomendadas por guías y autores para tratar la psoriasis del cuero cabelludo. Puede añadirse ácido salicílico al corticoesteroide para quitar la escama si hay mucha hiperqueratosis40,74,78.
Tratamiento tópico de elección para cara, pliegues y genitales. Estas localizaciones se tratan con un corticoide de potencia baja o moderada, 1 o 2 veces al día, durante 2 semanas40,74. En estas localizaciones, los corticoides no deben usarse más de 1-2 semanas al mes40. Otra posibilidad es aplicar un corticoide de potencia alta, pero durante menos tiempo60,74. Los inhibidores de la calcineurina y los análogos de la vitamina D (el calcitriol es menos irritativo60) también son útiles74,75,77.
Tratamiento de mantenimiento a largo plazo
Se aconseja el tratamiento de mantenimiento una vez que el brote remita, para prevenir nuevos brotes70,71,74–76.
El tratamiento preferido por la mayoría de los expertos es la combinación de calcipotriol con betametasona en dosis fijas 2 días a la semana70,71,74–76,78.
Otra opción es usar el mismo fármaco que para el tratamiento de inducción, pero con menor frecuencia (por ejemplo, 2 veces a la semana)61,75.
La tabla 4 muestra el tratamiento tópico recomendado en función de la localización.
Tabla 4. Recomendaciones para el tratamiento tópico de la psoriasis en placas, según la localización
| Localización | Brote | Mantenimiento |
| Tronco y miembros | Calcipotriol + betametasona 1 v/d durante 4 semanas40,74
Corticoide de potencia alta o muy alta74 Análogo de la vitamina D74 |
Calcipotriol + betametasona 2 v/sem74
Mismo fármaco que para el tratamiento de inducción, pero menos frecuente (p. ej., 2 v/sem)61,75 |
| Cuero cabelludo | Calcipotriol + betametasona 1 v/d74 durante 4 a 12 semanas74,77
Corticoide de potencia alta o muy alta74 Ácido salicílico más corticoesteroide74 |
Calcipotriol + betametasona 2 v/sem74,78
Mismo fármaco que para el tratamiento de inducción, pero menos frecuente (p. ej., 2 v/sem)75 |
| Cara | Corticoide de potencia baja o moderada, 1 o 2 v/día durante 2 semanas40,74
Inhibidores de la calcineurina74,75,77 Análogos de la vitamina D75 |
Corticoide 1 v/d o análogo de la vitamina D75 |
| Pliegues y genitales | Corticoide de potencia baja o moderada, 1 o 2 v/día durante 2 semanas40,74,79
Inhibidores de la calcineurina74,75,77,79 Análogos de la vitamina D74,79 |
Corticoide o inhibidor de la calcineurina 1 v/sem75 |
Fuente: elaboración propia a partir de las referencias
Fototerapia
La fototerapia puede ser una opción eficaz para pacientes con psoriasis de moderada a grave sin artritis psoriásica4.
La fototerapia de elección es la radiación ultravioleta B de banda estrecha60.
La radiación ultravioleta (UV) tiene un efecto antiproliferativo y antiinflamatorio. Es una opción terapéutica en la psoriasis moderada a grave sin artritis psoriásica4 o cuando los medicamentos tópicos han fracasado80.
La radiación UV terapéutica puede administrarse en tres modalidades: ultravioleta B (UVB) de banda ancha, ultravioleta B (UVB) de banda estrecha y fotoquimioterapia PUVA, es decir, aplicando radiación ultravioleta A después de la administración oral o tópica de un psoraleno, que actúa como fotosensibilizante80.
La radiación UVB de banda estrecha, que incluye solo las longitudes de onda más eficaces del espectro para el tratamiento de la psoriasis, ha reemplazado en gran medida a la radiación UVB de banda ancha4, debido a que tiene menos efectos adversos, mayores tasas de respuesta y mayor rapidez de acción80.
Por otro lado, la radiación UV de banda estrecha tiene menos efectos adversos y un riesgo cancerígeno menor que la PUVA80, no requiere medicación oral antes de cada sesión60 y es segura durante el embarazo80. Por estos motivos, es la modalidad de fototerapia más recomendable, a pesar de que la radiación PUVA ha mostrado ser más efectiva en diversos estudios60,80.
La fototerapia se administra normalmente 3 veces a la semana durante la fase de tratamiento. Una vez que se alcanza una respuesta satisfactoria, se disminuye la frecuencia a la mínima necesaria para mantener el resultado60.
Otras modalidades de fototerapia incluyen la fototerapia domiciliaria, el láser de excímeros y la terapia fotodinámica60.
En un estudio con 196 pacientes, la fototerapia domiciliaria demostró ser igual de efectiva y segura que la llevada a cabo en el centro sanitario. Es una opción para pacientes que precisen fototerapia a largo plazo y no deseen desplazarse60.
La radiación UVB dirigida mediante láser de excímeros es una opción para tratar áreas localizadas de psoriasis. Tiene la ventaja de que respeta la piel sana, permite dosis más altas, la respuesta es más rápida y el riesgo es menor60.
La terapia fotodinámica requiere la aplicación de un fotosensibilizante tópico o sistémico, que se depositará en las células metabólicamente más activas y que, posteriormente, se activará con una fuente de luz. En la psoriasis no ha demostrado un beneficio significativo, así que no está indicada80.
En general, los pacientes que precisan un tratamiento más allá del tópico prefieren el tratamiento sistémico a la fototerapia4. La fototerapia puede combinarse con otros tratamientos, tanto tópicos como sistémicos80.
Tratamiento sistémico
Una parte de los pacientes con psoriasis precisarán tratamiento sistémico. Este puede ser con medicamentos sistémicos clásicos o convencionales o con medicamentos biológicos.
¿Cuándo empezar el tratamiento sistémico?
Los criterios para comenzar el tratamiento sistémico se muestran en el Cuadro 8.
Cuadro 8. Indicaciones para comenzar el tratamiento sistémico
CUALQUIERA de los siguientes:
|
BSA: área de superficie corporal; DLQI: índice de calidad de vida en dermatología; PASI: índice de intensidad y extensión de la psoriasis.
* En el documento de consenso de la AEDV de 201655, el criterio era «formas extensas de psoriasis (BSA >5 %-10 %)». Por su parte, la National Psoriasis Foundation define la psoriasis extensa como aquella en la cual el BSA es >3 % y recomienda comenzar el tratamiento sistémico a partir de este valor de BSA42.
Fuente: Carrascosa y otros45
En cuanto a qué tratamiento sistémico escoger, por lo general, las guías clínicas recomiendan primero un medicamento sistémico convencional40,47,49,81–83, a pesar de que tienen más efectos secundarios55 y de que los biológicos son los medicamentos más efectivos para la psoriasis moderada a grave60,84. La limitación para el tratamiento con medicamentos biológicos es el coste55.
Por su parte, en el consenso de 2021, el Grupo de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología explica que todas las terapias biológicas, incluyendo biosimilares y moléculas sintéticas de nueva generación que han demostrado eficacia y seguridad y que han sido aprobadas por la European Medicines Agency (EMA), se pueden prescribir en la práctica diaria y deben estar a disposición de los dermatólogos en función de las indicaciones de su ficha técnica. En este consenso no menciona (como sí hacía en el consenso de 2016) que un criterio para el uso de biológicos sea «pacientes en los que no se consigue un control eficaz de la enfermedad con los medicamentos sistémicos disponibles, solos o en politerapia». En referencia a las indicaciones aprobadas en España para los biológicos, explica que infliximab, etanercept y ustekinumab están indicados para los pacientes con contraindicación o intolerancia a otros tratamientos sistémicos como metotrexato o PUVA, y que el resto tiene indicación según ficha técnica en primera línea de tratamiento para pacientes con psoriasis candidatos a tratamiento sistémico. El GPS señala que en el sistema sanitario público español, guselkumab, risankizumab y tildrakizumab presentan como restricción a su reembolso el paso previo por un fármaco anti-TNF-α y considera que esta restricción (incluida en las consideraciones finales del grupo de coordinación del posicionamiento terapéutico) es arbitraria y representa una limitación no fundamentada en el propio informe de posicionamiento terapéutico, que propone emplear criterios de eficiencia45.
En la guía europea publicada en 2022 (Euroguiderm Guideline for the Systemic Treatment of Psoriasis Vulgaris), se recomienda empezar con medicamentos sistémicos convencionales como primera línea de tratamiento en la mayoría de los pacientes. Sin embargo, en caso de enfermedad grave, en los que no se puede esperar suficiente éxito terapéutico con los medicamentos convencionales, se sugiere empezar con un biológico aprobado por la EMA como primera línea de tratamiento51.
¿Cuáles son los objetivos terapéuticos?
Los últimos años han surgido nuevos fármacos y evidencia de calidad que permiten elevar las expectativas de los objetivos terapéuticos en la psoriasis moderada-grave. El GPS establece objetivos terapéuticos óptimos o ideales y objetivos clínicamente adecuados45.
Por primera vez, teniendo en cuenta la nueva evidencia disponible, incluye entre los objetivos óptimos el aclaramiento completo ―definido como PASI absoluto 0 o respuesta PASI 100―, ya que reconoce que actualmente son objetivos alcanzables al menos para un grupo de pacientes. También incrementa el límite superior de los objetivos clínicamente adecuados, incluyendo ahora la respuesta PASI 90 y el PASI absoluto ≤2-3 (en el documento anterior se establecía en la respuesta PASI 75 y PASI absoluto ≤5). Sin embargo, el GPS reconoce que hay escenarios en la práctica clínica ―en particular, aquellos pacientes en los que han fracasado varias terapias biológicas previas― en que se pueden aceptar objetivos de tratamiento menos exigentes y en los que puede ser todavía adecuada como objetivo terapéutico una respuesta PASI 75 o un PASI absoluto ≤545.
Los objetivos terapéuticos se muestran en el Cuadro 9.
Cuadro 9. Objetivos del tratamiento de la psoriasis moderada a grave
Entre los objetivos óptimos deben incluirse:
Entre los objetivos clínicamente adecuados deben incluirse:
En pacientes concretos o situaciones determinadas (fracasos previos, comorbilidades asociadas) pueden considerarse clínicamente adecuados otros objetivos terapéuticos (respuesta PASI 75, PASI ≤5). |
BSA: área de superficie corporal; DLQI: índice de calidad de vida en dermatología; PASI: índice de intensidad y extensión de la psoriasis; PGA: Physician’s Global Assessment
Fuente: Carrascosa y otros45
También la National Psoriasis Foundation considera que, con los nuevos tratamientos sistémicos, es posible alcanzar la remisión casi completa (Tabla 4)85.
Tabla 4. Objetivos del tratamiento de la psoriasis en placas de moderada a grave, según la National Psoriasis Foundation
| Instrumento de evaluación de elección en la práctica clínica | BSA |
| Respuesta inicial aceptable
|
BSA ≤3 % o mejoría del BSA ≥75 % respecto del basal 3 meses después del inicio del tratamiento |
| Objetivo de respuesta inicial | BSA ≤1 % a los 3 meses del inicio del tratamiento |
| Objetivo de respuesta de mantenimiento | BSA ≤1 % en todas las evaluaciones semestrales durante la terapia de mantenimiento |
| Instrumento de evaluación de elección en la práctica clínica | BSA |
| Respuesta inicial aceptable
|
BSA ≤3 % o mejoría del BSA ≥75 % respecto del basal 3 meses después del inicio del tratamiento |
| Objetivo de respuesta inicial | BSA ≤1 % a los 3 meses del inicio del tratamiento |
| Objetivo de respuesta de mantenimiento | BSA ≤1 % en todas las evaluaciones semestrales durante la terapia de mantenimiento |
BSA: área de superficie corporal
Fuente: Armstrong y otros85
En cualquier caso, los objetivos terapéuticos deben individualizarse y tomar en cuenta las preferencias y la calidad de vida del paciente42,85.
¿Cuándo evaluar la respuesta al tratamiento sistémico?
El momento de evaluar la respuesta inicial al tratamiento depende del medicamento prescrito81, aunque suele ser entre las 12-16 semanas47,57,85.
En cuanto a las revisiones de la eficacia durante la etapa de mantenimiento, el consenso español de 2016 recomienda evaluar la respuesta cada 8-12 semanas34. Las guías francesa47 y británica81 y la National Psoriasis Foundation85 proponen un intervalo de 6 meses.
Medicamentos sistémicos clásicos
Los medicamentos sistémicos convencionales son el metotrexato, la acitretina, la ciclosporina, los fumaratos y el apremilast. La elección de uno u otro dependerá de la eficacia, los efectos adversos, las enfermedades concomitantes, las preferencias del paciente y el coste60.
Metotrexato (Tabla 5)
Es el medicamento sistémico más antiguo para el tratamiento de la psoriasis. Parece que el mecanismo de acción en la psoriasis es el efecto inmunosupresor sobre los linfocitos T activados60.
El metotrexato sigue siendo muy útil tanto en monoterapia como en combinación con ciertos medicamentos biológicos. La guía NICE lo recomienda como primera opción en pacientes que cumplen los criterios para recibir tratamiento sistémico40. También es efectivo para la artritis psoriásica y para la psoriasis ungueal60.
En la psoriasis en placas, se administra una vez por semana. En este sentido, el hecho de que se hayan producido errores de posología (diaria en vez de semanal) que han producido reacciones aversas graves llevó al PRAC (Pharmacovigilance Risk Assessment Committee de la EMA) a tomar medidas y dar recomendaciones encaminadas a evitar estos errores. La AEMPS también ha reforzado la información y ha tomado medidas al respecto. Asimismo, las guías europeas más recientes indican que el metotrexato debería administrarse preferentemente de forma subcutánea, 1 vez por semana, para aumentar la seguridad (la toma oral tiene mayor riesgo de sobredosis, pues la probabilidad de que los pacientes tomen los comprimidos a diario en vez de semanalmente es mayor) y mejorar la biodisponibilidad51.
El metotrexato es menos efectivo que los medicamentos biológicos para la psoriasis cutánea86. El efecto clínico suele observarse normalmente tras 2-6 semanas de tratamiento87.
Tabla 5. Metotrexato
| Indicaciones en psoriasis | Psoriasis incapacitante recalcitrante grave, que no responde adecuadamente a otras formas de tratamiento como fototerapia, PUVA y retinoides, y artritis psoriásica grave en pacientes adultos. |
| Dosis | 7,5-25 mg/sem
Empezar por 7,5 mg (5 en ancianos) y ajustar cada 4-8 sem |
| Análisis pretratamiento* | Hemograma, pruebas de función renal, sistemático de orina, enzimas hepáticas, bilirrubina, albúmina (en casos seleccionados), radiografía de tórax, test de embarazo, VIH, VHB y VHC, otras pruebas hepáticas** |
| Análisis durante el tratamiento* | A los 7 días: hemograma
Cada 4 semanas, durante 2 meses: hemograma, creatinina, enzimas hepáticas, albúmina (si necesario) Después, cada 3 meses: hemograma, creatinina, enzimas hepáticas, albúmina (si necesario), otras pruebas hepáticas** |
| Efectos adversos | Gastrointestinales (estomatitis, dispepsia, dolor abdominal, náuseas, pérdida del apetito), anomalías en las pruebas de función hepática, leucopenia, anemia, trombocitopenia, cefalea, cansancio, somnolencia, neumonía, alveolitis/neumonitis intersticial asociadas con frecuencia a eosinofilia, úlceras bucales, diarrea, exantema, eritema, prurito, anorexia, cefalea, teratogenia, nefrotoxicidad, mielosupresión, hepatotoxicidad, fibrosis pulmonar, reacciones dermatológicas graves, infecciones, linfoma |
| Contraindicaciones | Hipersensibilidad a alguno de los componentes, embarazo, lactancia, discrasias sanguíneas persistentes, abuso de alcohol, insuficiencia hepática o renal grave, inmunodeficiencia, vacunación concurrente con vacunas de microorganismos vivos, estomatitis, úlceras de la cavidad oral y enfermedad ulcerosa gastrointestinal activa conocida, infecciones graves |
| Instrucciones al paciente | Evitar el alcohol
Evitar AINE e IBP Usar métodos anticonceptivos, también si es el hombre quien toma el metotrexato |
| Uso combinado | No usar con acitretina, ciclosporina ni fumaratos |
| Observaciones
|
Útil para inducción y mantenimiento. Efectivo en artritis psoriásica y psoriasis ungueal
Administrar 1 mg/d de ácido fólico, excepto el día que se tome el metotrexato, o bien 5 mg 1 vez/sem (24 horas después del metotrexato) |
AINE: antiinflamatorios no esteroideos; d: día; IBP: inhibidores de la bomba de protones; sem: semana; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana
* No todas las pruebas son necesarias en todos los pacientes, sino que se deben tener en cuenta los antecedentes, los factores de riesgo y las características del paciente51.
** Las guías europeas recomiendan solicitar el PIIINP (péptido aminoterminal de protocolageno III) antes de empezar el tratamiento y después cada 3 meses, si está disponible51. La American Academy of Dermatology y la National Psoriasis Foundation abogan por evaluar la fibrosis hepática mediante nuevas técnicas no invasivas60,86.
Fuente: elaboración propia a partir de la ficha técnica de metotrexato87,88, Feldman60 y Nast y otros51.
Acitetrina (Tabla 6)
La acitretina es un retinoide oral que se usa en pacientes con psoriasis grave ―incluida la pustulosa y la eritrodérmica― y en pacientes inmunocomprometidos (por ejemplo, con VIH)42,60. Es particularmente efectiva en la psoriasis palmoplantar4.
La eficacia en la psoriasis en placas en monoterapia es modesta. Se utiliza habitualmente en combinación con fototerapia, con lo cual se consigue una mejora clínica mayor y más rápida que con cualquiera de estas terapias por separado4.
Tabla 6. Acitretina
| Indicaciones en psoriasis | Formas graves y generalizadas de psoriasis refractarias; psoriasis pustulosa de manos y pies |
| Dosis | 25 a 75 mg/d (por lo general, 30 mg/d), en 1 toma, con comida
Empezar por 25 o 30 mg/d y subir, si es preciso, a las 2-4 semanas. En general, 30 mg/d durante 6-8 semanas adicionales permite lograr el efecto óptimo, y se puede suspender. No se recomienda el tratamiento a largo plazo. |
| Análisis pretratamiento | Función hepática, función renal, perfil lipídico, hemograma, glucemia, test de embarazo |
| Análisis durante el tratamiento | Cada 1-2 semanas durante 2 meses: función hepática (a las 4 semanas, pedir también perfil lipídico, y a los 2 meses, hemograma)
Después, cada 3 meses: perfil lipídico, función hepática, hemograma Cada mes, hasta 3 años después de finalizar el tratamiento: test de embarazo |
| Efectos adversos | Sequedad de piel y mucosas (xeroftalmia, xerostomía, rinitis, queilitis, etc.), alopecia, pruebas anómalas de la función hepática, hiperlipemia, cefalea, estomatitis, trastornos gastrointestinales, artromialgias, edema periférico, teratogenia, hipertensión craneal benigna |
| Contraindicaciones | Embarazo (desde un mes antes de iniciar tratamiento y hasta 3 años después de suspenderlo); lactancia; insuficiencia hepática grave; insuficiencia renal grave; hiperlipemia crónica; hipersensibilidad a alguno de los componentes; uso concomitante con vitamina A u otros retinoides, metotrexato, etretinato o tetraciclinas |
| Instrucciones al paciente | Dieta y hábitos saludables para controlar la hiperlipemia
Evitar embarazo, hasta 3 años después Evitar el alcohol No donar sangre durante el tratamiento y hasta 3 años después |
Fuente: elaboración propia a partir de la ficha técnica de acitetrina89 y de Nast y otros51.
La ciclosporina es un tratamiento rápido y efectivo para la psoriasis. Actúa inhibiendo la actividad de los linfocitos T. El efecto clínico se empieza a observar a las 4 semanas de tratamiento60.
Su uso está limitado por la gran cantidad de efectos adversos (sobre todo, nefrotoxicidad) e interacciones medicamentosas. Por eso, las guías recomiendan no tomarla más de 1 o 2 años4,42,51.
Tabla 7. Ciclosporina
| Indicaciones en psoriasis | Psoriasis grave en pacientes en los que la terapia convencional resulta inadecuada o ineficaz. |
| Dosis | 2,5-5 mg/kg/d, oral
Empezar por 2,5 mg/kg/d, en 2 dosis, y ajustar cada 4 semanas |
| Análisis pretratamiento* | Toma de tensión arterial en 2 ocasiones separadas, hemograma, función hepática, sodio, potasio, creatinina, sistemático de orina, ácido úrico, perfil lipídico, HIV, VHB, magnesio (solo si hay calambres), test de embarazo |
| Análisis durante el tratamiento* | A las 4 semanas: Hemograma, función hepática, sodio, potasio, creatinina, sistemático de orina, ácido úrico
A las 8 semanas: Hemograma, función hepática, sodio, potasio, creatinina, ácido úrico, perfil lipídico, magnesio (si hay calambres) A las 12 semanas: Hemograma, función hepática, sodio, potasio, creatinina, ácido úrico, perfil lipídico, magnesio (si hay calambres) A las 16 semanas y, después, cada 4-8 semanas: Hemograma, función hepática, sodio, potasio, creatinina, sistemático de orina, ácido úrico |
| Efectos adversos | Insuficiencia renal, hipertensión, hiperlipidemia, temblor, cefalea, hirsutismo, leucopenia, hiperglucemia, anorexia, hiperuricemia, hiperpotasemia, hipomagnesemia, parestesias, convulsiones, rubor, náuseas, vómitos, malestar/dolor abdominal, diarrea, hiperplasia gingival, úlcera péptica, disfunción hepática, calambres musculares, mialgia, hipertricosis, acné, pirexia, fatiga, aumento del riesgo de linfoma y carcinoma de células escamosas |
| Contraindicaciones | Hipersensibilidad a alguno de sus componentes, combinación con hierba de San Juan o con medicamentos que son sustrato de la bomba de flujo multifármaco glicoproteína-P o de las proteínas transportadoras de aniones orgánicos |
| Instrucciones al paciente | Evitar el zumo de pomelo
No recibir vacunas de virus vivos atenuados Evitar los AINE Evitar el alcohol No dar el pecho Evitar el embarazo (los anticonceptivos con progesterona son menos efectivos) Utilizar fotoprotección |
| Uso combinado | No asociar a fototerapia ni otros inmunosupresores |
AINE: antiinflamatorios no esteroideos; d: día; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana
* No todas las pruebas son necesarias en todos los pacientes, sino que se deben tener en cuenta los antecedentes, los factores de riesgo y las características del paciente51.
Fuente: elaboración propia a partir de la ficha técnica de ciclosporina90 y de Nast y otros51.
Apremilast (Tabla 8)
La Agencia Europea de Medicamentos (EMA) aprobó el apremilast en 2015 como tratamiento de segunda línea para la psoriasis en placas moderada a grave en pacientes que no responden a otras terapias sistémicas como el metotrexato, la ciclosporina o la terapia PUVA, o bien no las toleren o estén contraindicadas91. También es efectivo en la artritis psoriásica60.
Las guías europeas lo recomiendan como fármaco de segunda línea cuando se desea un tratamiento oral y los sistémicos clásicos no han logrado una respuesta adecuada, no se toleran o están contraindicados51.
Tabla 8. Apremilast
| Indicaciones en psoriasis | Psoriasis en placas crónica de moderada a grave en pacientes adultos que no han respondido o tienen contraindicado o no toleran otro tratamiento sistémico, incluyendo ciclosporina, metotrexato o psoraleno y luz ultravioleta A (PUVA). |
| Dosis | 30 mg por vía oral, 2 veces al día, cada 12 horas aprox. (mañana y noche), sin restricción de alimentos
Ajuste posológico durante 5 días, según la pauta recomendada en la ficha técnica, para mejorar la tolerabilidad gastrointestinal |
| Análisis pretratamiento | Hemograma, función hepática, función renal, test de embarazo, VHB*, VHC*, VIH*, control de peso en pacientes con peso bajo |
| Análisis durante el tratamiento | No necesarios (excepto si hay alteraciones en los análisis basales)
Control de peso en pacientes con peso bajo Evaluar depresión, ideación suicida y cambios de humor |
| Efectos adversos | Diarrea, náuseas, infecciones del tracto respiratorio superior, cefalea, disminución del apetito, vómitos, dispepsia, dolor abdominal superior, enfermedad por reflujo gastroesofágico, moviientos intestinales frecuentes, depresión, insomnio, tos, bronquitis, nasofaringitis, dolor de espalda, fatiga, pérdida de peso |
| Contraindicaciones | Hipersensibilidad a los componentes, embarazo |
| Instrucciones al paciente | Anticoncepción |
VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana
* Opcionales
Fuente: elaboración propia a partir de la ficha técnica de apremilast91, de Feldman60 y de Nast y otros51.
Los ésteres de ácido fumárico o fumaratos (EAF) se han utilizado para tratar lo psoriasis moderada a grave principalmente en Alemania, aunque también en otros países europeos. En ese país son el tratamiento sistémico más usado. El producto comercializado (Fumaderm®) allí es una mezcla de diferentes EAF, de los cuales el dimetilfumarato (DMF) es el principal componente activo. En 2017, la EMA aprobó una nueva forma oral, Skilarence®, que contiene solo DMF92.
Las guías europeas recomiendan los fumaratos como tratamiento sistémico clásico de primera línea, al mismo nivel que la acitretina, el metotrexato y la ciclosporina51.
Los fumaratos son una opción de tratamiento segura para los pacientes que toman otros medicamentos debido a sus comorbilidades, ya que no se conocen interacciones de tipo metabólico con otros fármacos92.
Tabla 9. Dimetilfumarato
| Indicaciones en psoriasis | Psoriasis en placas de moderada a grave en adultos que precisan de un tratamiento con un medicamento sistémico. |
| Dosis | Máximo 720 mg al día, de 1 a 3 veces al día.
Empezar por 30 mg y aumentar gradualmente cada semana, según la pauta recomendada en la ficha técnica. |
| Análisis pretratamiento | Hemograma, enzimas hepáticas, creatinina sérica, análisis de orina, test de embarazo. |
| Análisis durante el tratamiento | Cada 3 meses: hemograma*, enzimas hepáticas, creatinina sérica, análisis de orina. |
| Efectos adversos | Diarrea, dolor abdominal, distensión abdominal, náuseas, rubefacción, vómitos, flatulencia, dispepsia, estreñimiento, malestar abdominal, linfopenia, leucopenia, eosinofilia, leucocitosis, apetito disminuido, cefalea, parestesias, eritema, sensación de ardor en la piel, prurito, fatiga, sensación de calor, astenia, incremento de enzimas hepáticas. |
| Contraindicaciones | Hipersensibilidad a alguno de los componentes, trastornos gastrointestinales graves, insuficiencia renal o hepática grave, embarazo y lactancia. |
| Instrucciones al paciente | Informar al paciente de los acontecimientos adversos más frecuentes.
Los comprimidos no se deben triturar, disolver o masticar. Tomarlo durante las comidas, con suficiente líquido, con leche u otro derivado lácteo. Existe la posibilidad de ajustar la dosis en función de la tolerabilidad y respuesta. |
| Uso combinado | Poca evidencia. Usar con precaución cuando se administra concomitantemente con otra terapia antipsoriásica sistémica.
Durante las primeras semanas, puede usarse con medicación tópica o fototerapia, para aumentar la mejoría clínica y la eficacia. |
* Si los leucocitos son <3,0 x 109/l, se debe interrumpir el tratamiento. Si los linfocitos son ≥0,7 x 109/l y <1,0 x 109/l, el hemograma debe ser mensual hasta que los valores vuelvan a ser ≥1,0 x 109/l durante dos analíticas consecutivas; después, seguir cada 3 meses. Si los linfocitos son <0,7 x 109/l, debe repetirse el hemograma y detenerse el tratamiento si continúan así.
Fuente: elaboración propia a partir de la ficha técnica de dimetilfumarato93, de Mrowietz y otros92 y de Nast y otros51.
Medicamentos biológicos
Los medicamentos biológicos para la psoriasis pueden dividirse en cuatro grupos: inhibidores del TNF α, inhibidores de las interleucinas IL-12 e IL-23, inhibidores de la interleucina IL-17 e inhibidores de la interleucina IL-23.
Los medicamentos biológicos tienen una excelente eficacia a corto y a largo plazo y una tolerabilidad favorable60.
¿Qué tratamiento biológico elegir?
La AEDV indica que los inhibidores de la IL-17 y los inhibidores de la IL-23 (antip19), teniendo en cuenta su eficacia en comparación directa e indirecta con otros fármacos y su perfil de seguridad, son los grupos que presentan, en su conjunto, un perfil con mejores perspectivas de conseguir los objetivos terapéuticos Deben tomarse en cuenta también las comorbilidades45.
Los últimos años se han publicado varios metanálisis en red que comparan varios fármacos biológicos de manera directa e indirecta94.
No obstante, varios autores alertan de las limitaciones de estos metanálisis y recomiendan a los clínicos interpretarlos con precaución. Muchos de ellos son redundantes; la mayoría incluyen solo una parte de los fármacos (de 47 metanálisis, solo 2 incluían todos los tratamientos) y se enfocan solo en la eficacia, ignorando los resultados de seguridad; la calidad de la metodología varía y muchos (39 de los 47) ofrecen resultados de poca confianza94–96.
Con esto en mente, exponemos los resultados de algunos metanálisis recientes:
- Un metanálisis en red (revisión Cochrane) de 2022 encontró que, en comparación con placebo, los biológicos infliximab, bimekizumab, ixekizumab y risankizumab fueron los más efectivos para alcanzar el PASI 90 en personas con psoriasis moderada-grave sobre la base de evidencia de alta certeza. Esta evidencia se limita al corto plazo (8 a 24 semanas tras la aleatorización)84.
- Un metanálisis en red publicado en 2022 que utilizó el número que es necesario tratar (NNT) para evaluar la eficacia, halló que el menor NNT para alcanzar el PASI 90 a las semanas 4, 8 y 12 se dio con el brodalumab y el ixekizumab; para lograr el PASI 90/100 a la semana 16, con el ixekizumab; y para el PASI 100 a la semana 12, con el brodalumab. Tras 48/52 semanas, el risenkizumab fue el más eficaz para alcanzar el PASI 90/100 (junto con el guselkumab, brodalumab e ixekizumab para el PASI 90 y con el brodalumab e ixekizumab para el PASI 100). El ixekizumab fue el más eficaz para el DLQI a la semana 1297.
- Un metanális en red publicado en 2021, por su parte, mostró que la tasa de respuesta PASI 100 a corto plazo fue mayor con ixekizumab, brodalumab y risankizumab, y a largo plazo, con risankizumab98.
¿Qué análisis son necesarios antes de pautar un tratamiento biológico?
Antes de empezar un tratamiento con medicamentos biológicos, se recomienda realizar algunas pruebas (Cuadro 11). Además, en todos los casos están contraindicadas las vacunas de virus vivos atenuados57.
Cuadro 11. Pruebas recomendadas antes de iniciar el tratamiento con medicamentos biológicos
|
Fuente: elaboración propia a partir de Menter y otros57.
Inhibidores del TNF α
Son los primeros medicamentos biológicos usados para tratar la psoriasis. Incluyen el infliximab, el etanercept, el adalimumab, el certolizumab y el golimumab. Actúan uniéndose al TNF ―y, por tanto, impidiendo su unión al receptor― o inhibiendo la activación del receptor del TNF4. El golimumab solo está aprobado para la artritis psoriásica99; el resto, tanto para la psoriasis en placas como para la artritis psoriásica100–103.
Entre sus efectos adversos se encuentran infecciones, que pueden ser graves (incluidas tuberculosis y sepsis), enfermedades autoinmunes (lupus y enfermedades desmielinizantes) y mayor riesgo de cáncer (linfoma)104.
En general, la eficacia del tratamiento se evalúa a las 12-16 semanas57.
En la Tabla 10 se muestran las principales características de los inhibidores del TNF α.
Tabla 10. Inhibidores del TNF α
| Inhibidor del TNF α | Dosis | Efectos adversos muy frecuentes y frecuentes/ contraindicaciones |
| Etanercept
|
25 mg s.c. 2 v/sem o 50 mg 1 v/sem durante 12 sem; seguir con 50 mg, 1 v/sem
Evaluar la eficacia a las 12 semanas |
Reacciones en el sitio de inyección, infecciones, cefalea, reacciones alérgicas, prurito, erupción, pirexia
Contraindicaciones: hipersensibilidad a algún componente, infecciones activas, sepsis o riesgo de sepsis |
| Infliximab
|
5 mg/kg i.v. la sem 0, 2 y 6; después, cada 8 sem
Evaluar la eficacia a las 14 sem |
Reacción relacionada con la perfusión, dolor, infecciones víricas, infecciones del tracto respiratorio superior, sinusitis, cefaleas, dolor abdominal, náuseas, infecciones bacterianas, neutropenia, leucopenia, anemia, linfadenopatía, síntomas respiratorios alérgicos, depresión, insomnio, vértigo, mareo, hipoestesia, parestesia, conjuntivitis, taquicardia, palpitaciones, hipotensión, hipertensión, equimosis, sofocos, rubefacción, infecciones del tracto respiratorio inferior, disnea, epistaxis, hemorragia gastrointestinal, diarrea, dispepsia, reflujo gastroesofágico, estreñimiento, función hepática anormal, transaminasas elevadas, nueva aparición o empeoramiento de la psoriasis, urticaria, erupción, prurito, hiperhidrosis, piel seca, dermatitis fúngica, eccema, alopecia, artralgias, mialgias, dolor de espalda, infecciones urinarias, dolor torácico, fatiga, fiebre, reacción en la zona de inyección, escalofríos, edema
Contraindicaciones: hipersensibilidad a algún componente, TBC u otras infecciones graves, IC grados III o IV de la NYHA |
| Adalimumab
|
80 mg s.c. la sem 0 y 40 mg la sem 1; después, 40 mg cada 2 sem
Puede aumentarse a 40 mg/sem u 80 mg cada 2 sem, si no hay respuesta adecuada, y volver a reducir si la respuesta es adecuada Evaluar la eficacia a las 16 sem |
Reacción en el lugar de inyección, infecciones, cefalea, cáncer de piel excluido el melanoma (incluidos el carcinoma de células basales y el carcinoma de células escamosas), neoplasia benigna, dolor abdominal, náuseas y vómitos, incremento de enzimas hepáticas, rash (incluido rash exfoliativo), dolor musculoesquelético, leucopenia, anemia, leucocitosis, trombocitopenia, hipersensibilidad, alergias (incluida la estacional), incremento de lípidos, hipopotasemia, incremento de ácido úrico, sodio plasmático anormal, hipocalcemia, hiperglucemia, hipofosfatemia, deshidratación, cambios de humor (incluida la depresión), ansiedad, insomnio, parestesias, migraña, compresión de la raíz nerviosa, alteración visual, conjuntivitis, blefaritis, hinchazón de ojos, vértigo, taquicardia, hipertensión, rubor, hematomas, asma, disnea, tos, hemorragia gastrointestinal, dispepsia, enfermedad por reflujo gastroesofágico, síndrome del ojo seco, empeoramiento de la psoriasis existente o psoriasis de nueva aparición, urticaria, aumento de moratones (incluida la púrpura), dermatitis (incluido el eccema), onicoclasia, hiperhidrosis, alopecia, prurito, espasmos musculares (incluido el aumento plasmático de la creatina-fosfocinasa, insuficiencia renal, hematuria, dolor de pecho, edema, pirexia, alteraciones de la coagulación y el sangrado (incluida la prolongación del tiempo de tromboplastina parcial activada), presencia de autoanticuerpos (incluidos anticuerpos de ADN bicatenario), incremento de la lactato deshidrogenasa plasmática, alteraciones de la cicatrización
Contraindicaciones: hipersensibilidad a algún componente, TBC activa u otras infecciones graves, IC grados III o IV de la NYHA |
| Certolizumab
|
400 mg s.c. las sem 0, 2 y 4; después, 200 mg cada 2 sem.
Se puede considerar una dosis de 400 mg cada 2 sem en los pacientes con respuesta insuficiente Evaluar la eficacia a las 16 sem |
Infecciones bacterianas y víricas, trastornos eosinofílicos, leucopenia, dolores de cabeza (incluida la migraña), alteraciones sensitivas, hipertensión, náuseas, hepatitis (incluido el aumento de las enzimas hepáticas), exantema, pirexia, dolor (cualquier localización), astenia, prurito (cualquier localización), reacciones en el lugar de la inyección
Contraindicaciones: hipersensibilidad a algún componente, TBC activa u otras infecciones graves, IC grados III o IV de la NYHA |
TNF: factor de necrosis tumoral; ICC: insuficiencia cardíaca crónica; NYHA: New York Heart Association; s.c.: subcutáneo; sem: semana; TBC: tuberculosis; v: vez
No incluimos el golimumab, por no tener indicación en la psoriasis en placas.
Fuente: fichas técnicas de los productos100–103
Inhibidores de las interleucinas 12 y 23
El ustekinumab (Tabla 11) es un anticuerpo monoclonal dirigido contra la subunidad p40, compartida por la IL-12 y la IL-23; por tanto, impide la unión de ambas interleucinas con sus receptores105.
También es útil en la artritis psoriásica, aunque es menos efectivo que los inhibidores del TNF α105. No se ha encontrado que aumente el riesgo de cáncer4.
Tabla 11. Inhibidores de las interleucinas 12 y 23
| Inhibidor de la IL-12/23 | Dosis | Efectos adversos / contraindicaciones |
| Ustekinumab
|
45 mg s.c. en las sem 0 y 4; después, cada 12 sem
Pacientes de >100 kg: mismo esquema, pero con 90 mg Evaluar la eficacia después de 12 semanas57 o a las 28 sem47 |
Infección de las vías respiratorias altas, nasofaringitis, sinusitis, mareo, cefalea, dolor orofaríngeo, diarrea, náuseas, vómitos, prurito, dolor de espalda, mialgias, artralgia, cansancio, eritema en el lugar de inyección, dolor en el lugar de inyección
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
s.c.: subcutáneo; sem: semana
Fuente: Aspectos destacados de la información de prescripción106 y ficha técnica de producto107
Inhibidores de la interleucina 17
Este grupo (Tabla 12) incluye el secukinumab, el ixekizumab, el brodalumab y el bimekizumab.
Se recomienda evaluar la eficacia a las 12 semanas de tratamiento57.
Al contrario que los inhibidores del TNF α, tanto los inhibidores de la IL-17 como el ustekinumab pueden usarse en personas con insuficiencia cardíaca o enfermedades desmielinizantes. Asimismo, no se asocian a un aumento del riesgo de cáncer4. Los inhibidores de la IL-17 se han asociado a infecciones por Candida. También pueden empeorar la enfermedad inflamatoria intestinal. El brodalumab se ha asociado a ideas suicidas57.
Tabla 12. Inhibidores de la interleucina 17
| Inhibidor de la IL-17 | Dosis | Efectos adversos / contraindicaciones |
| Secukinumab
|
300 mg s.c. las sem 0, 1, 2, 3 y 4; después, 300 mg cada 4 sem
Según la respuesta clínica, una dosis de mantenimiento de 300 mg cada 2 sem puede proporcionar un beneficio adicional a los pacientes que pesen ≥90 kg Evaluar la eficacia a las 16 sem |
Infecciones de las vías respiratorias altas, herpes oral, pie de atleta, cefalea, rinorrea, diarrea, náusea, fatiga
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
| Ixekizumab
|
160 mg s.c. la sem 0; 80 mg las sem 2, 4, 6, 8, 10 y 12; después, 80 mg cada 4 sem
Evaluar la eficacia entre las semanas 16 y 20 |
Reacciones en el sitio de inyección, infecciones del tracto respiratorio superior, tiña, herpes simple, dolor orofaríngeo, náuseas
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
| Brodalumab
|
210 mg s.c. las sem 0, 1 y 2; después, 210 mg cada 2 sem
Evaluar la eficacia entre las semanas 16 y 20 |
Infecciones (influenza, tiñas), cefalea, dolor orofaríngeo, diarrea, náuseas, artralgias, mialgias, fatiga, reacciones en el sitio de inyección,
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes, enfermedad de Crohn activa |
| Bimekizumab | 320 mg s.c. en las sem 0, 4, 8, 12 y 16; después, cada 8 sem
Evaluar la eficacia a las 16 sem |
Infecciones de las vías respiratorias altas, candidiasis oral, infecciones (tiña, oído, herpes simple), candidiasis orofaríngea, gastroenteritis, foliculitis, dolor de cabeza, dermatitis y eccema, acné, reacciones en el sitio de inyección, fatiga
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
EII: enfermedad inflamatoria intestinal; s.c.: subcutáneo; sem: semana
Fuente: fichas técnicas de los medicamentos108–111
Inhibidores de la interleucina 23
Este grupo (Tabla 13) incluye el tildrakizumab, el guselkumab y el risankizumab. Estos biológicos se unen a la subunidad p19 de la IL-23 para impedir la activación del receptor. El dejar la IL-12 intacta podría suponer un avance en el tratamiento de la psoriasis, ya que esta última vía ha demostrado efectos antiinflamatorios en modelos con animales. En teoría, también tendrían menor riesgo de infecciones105.
La eficacia debe evaluarse tras 12 semanas57. Los efectos adversos más frecuentes son la nasofaringitis, las infecciones de la vía respiratoria superior y la cefalea105.
Tabla 13. Inhibidores de la interleucina 23
| Inhibidor de la IL-23 | Dosis | Efectos adversos / contraindicaciones |
| Guselkumab
|
100 mg s.c. las sem 0 y 4; después, 100 mg cada 8 sem | Infecciones de las vías respiratorias, dolor de cabeza, diarrea, artralgias, reacciones en el sitio de inyección, transaminasas elevadas
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
| Tildrakizumab
|
100 mg s.c. las sem 0 y 4; después, cada 12 sem
En pacientes seleccionados (p. ej., impacto elevado de la enfermedad, peso ≥90 kg), puede ser más eficaz la dosis de 200 mg |
Infecciones del tracto respiratorio superior, cefalea, gastroenteritis, náuseas, diarrea, dolor en la zona de inyección, dolor de espalda
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
| Risankizumab
|
150 mg s.c. en las sem 0 y 4; después, cada 12 sem | Infecciones de las vías respiratorias altas, tiña, cefalea, fatiga, prurito, reacciones en el sitio de inyección
Contraindicaciones: hipersensibilidad a los componentes, infecciones activas clínicamente importantes |
IL: interleucina; PASI: índice de intensidad y extensión de la psoriasis; s.c.: subcutáneo; sem: semana
Fuentes: fichas técnicas de los medicamentos112–114
Nuevos medicamentos sistémicos
El deucravacitinib es un inhibidor selectivo de la tirosina-cinasa 2 (TYK2), una cinasa que participa en la señalización de las citocinas involucradas en la fisiopatología de la psoriasis, como la IL-23. La FDA lo aprobó en 2022 para el tratamiento de la psoriasis en placas moderada-grave en pacientes candidatos para el tratamiento sistémico o fototerapia Se administra por vía oral una vez al día.
En dos ensayos clínicos de fase 3, su eficacia fue superior a la del apremilast y el placebo en pacientes con psoriasis moderada o grave tanto a las 16 como a las 24 y 52 semanas115.
¿Tratamiento intermitente o continuo?
En la mayoría de los pacientes, la interrupción del tratamiento conlleva la recurrencia o recaída. No obstante, la toxicidad acumulativa específica de órgano de algunos medicamentos sistémicos convencionales hace preferible que se usen de forma intermitente o rotacional, en vez de manera continua55.
Por el contrario, los medicamentos biológicos carecen de ese tipo de toxicidad, por lo que se adaptan mejor a tratamientos continuos a largo plazo55. No obstante, como veremos a continuación, en pacientes con respuesta mantenida se puede valorar reducir la dosis, alargar el intervalo entre dosis o, incluso, suspender el tratamiento45.
¿Cómo actuar según la respuesta al tratamiento con biológicos?
El grupo de consenso español45 recomienda actuaciones diferentes durante el seguimiento del paciente con psoriasis moderada a grave en tratamiento con biológicos, en función de la respuesta.
Actuación en caso de fracaso terapéutico
El fracaso terapéutico puede ser45:
- Fracaso terapéutico primario: No se ha conseguido el objetivo terapéutico propuesto para el paciente a las 16-24 semanas de tratamiento (fase de inducción).
- Fracaso terapéutico secundario: Se pierde el objetivo terapéutico propuesto para el paciente durante la fase de mantenimiento.
- Fallo de seguridad: El paciente alcanza el objetivo terapéutico, pero a costa de toxicidad relevante que obliga a la suspensión del tratamiento.
Ante el fracaso terapéutico, se plantean varias opciones45:
- Cambiar de tratamiento (switch) a otro biológico, incluidos biosimilares o moléculas sintéticas de nueva generación.
- En casos determinados, se puede valorar:
- Combinaciones con medicamentos sistémicos convencionales o con medicamentos tópicos, preferiblemente de forma intermitente y temporal.
- Incrementar la dosis o acortar el intervalo (en aquellos fármacos en los que esté permitido).
Para seleccionar la segunda y posteriores líneas de tratamiento, se deben tomar en cuenta los siguientes factores45:
- La evidencia es limitada, sobre todo cuanto mayor es el número de líneas de tratamiento.
- Ante un fracaso terapéutico primario o secundario, se pueden emplear fármacos con el mismo o con otro mecanismo de acción. Si el fracaso es primario, se recomienda priorizar el cambio de mecanismo de acción o clase terapéutica.
- Si el fracaso terapéutico es por un acontecimiento adverso de clase relevante, se valorará cambiar de mecanismo de acción o clase terapéutica.
- En pacientes con determinadas comorbilidades o fracasos a varias pautas de terapia biológica, se aconseja flexibilidad en los objetivos terapéuticos. En la tercera línea y sucesivas resulta más difícil alcanzar resultados óptimos o adecuados.
Actuación para el mantenimiento de la respuesta
En cuanto al mantenimiento de la respuesta45:
- Los pacientes que alcanzan una respuesta óptima o clínicamente adecuada se consideran respondedores, y se mantendrá el tratamiento.
- En la práctica diaria, si se cumplen los objetivos terapéuticos establecidos de forma mantenida (6 meses-1 año), se puede valorar reducir la dosis o alargar el intervalo entre dosis (si la ficha técnica lo permite), de forma progresiva y monitorizando el mantenimiento del objetivo terapéutico.
- Si durante la minoración del tratamiento deja de cumplirse el objetivo terapéutico, se volverá a la pauta anterior.
- El mantenimiento de la respuesta requiere terapia continua en la mayoría de los pacientes. Sin embargo, si con la minoración se sigue manteniendo el objetivo terapéutico, se puede valorar suspender el tratamiento. En este sentido, el GPS señala que no existe una evidencia clara del porcentaje de pacientes que tendrán una recaída o exacerbación ni de la respuesta que se conseguirá reintroduciendo el tratamiento. Hay publicados algunos datos que indican que algunos pacientes podrían no alcanzar el nivel de respuesta logrado antes de discontinuar el tratamiento.
- Si tras suspender el fármaco se pierde el objetivo terapéutico, se valorará reintroducir el tratamiento previo.
Tratamiento de la psoriasis en placas de moderada a grave en poblaciones especiales
En algunas poblaciones, el tratamiento de la psoriasis tiene peculiaridades:
Infección crónica por VHB o VHC. Es de elección la fototerapia con luz UVB de banda estrecha, junto con medicación tópica. Si no es posible, se usarán medicamentos sistémicos. Los más indicados son el apremilast (por su mecanismo de acción) y el ustekinumab (que dispone de bastante evidencia de su seguridad a largo plazo). Otros medicamentos (secukinumab, ixekizumab, brodalumab, guselkumab y tildrakizumab) también serían una opción, dado su mecanismo de acción, pero disponen de menos pruebas científicas de su seguridad en esta población. Los inhibidores del TNF α no están recomendados116.
Infección por VIH. La fototerapia en combinación con medicamentos tópicos es el tratamiento de primera línea, junto con el tratamiento antirretroviral. La acitretina o el apremilast con tratamiento tópico son alternativas a la fototerapia. La ciclosporina, el metotrexato y los medicamentos biológicos deben reservarse para casos refractarios y usarse con mucho cuidado116 .
Infección tuberculosa latente. La detección de infección tuberculosa está indicada antes del tratamiento con inmunosupresores (es decir, todos los medicamentos biológicos ―en especial, los inhibidores del TNF α―, el metotrexato y la ciclosporina). Todos estos medicamentos deben usarse con precaución. Son preferibles las terapias sin efectos sistémicos inmunosupresores, como la fototerapia, la acitretina o el apremilast. Si es necesario dar un biológico, debe pasar al menos 1 mes desde el inicio de la terapia antituberculosa profiláctica116 .
Cáncer. El metotrexato y la ciclosporina aumentan el riesgo de trastornos linfoproliferativos. Los inhibidores del TNF α también se han asociado a un aumento del riesgo de cáncer. Por el contrario, no se ha demostrado una asociación entre el cáncer y el ustekinumab, secukinumab, ixekizumab, brodalumab, guselkumab y tildrakizumab. La fototerapia y la acitretina generalmente también se consideran seguras para los pacientes con antecedentes de neoplasias hematológicas o tumores sólidos116 . Los fumaratos no aumentan el riesgo de neoplasias, así que también son una opción segura92.
Embarazo. El tratamiento de elección es la fototerapia. Como segunda línea si esta no es efectiva están los inhibidores del TNF α y la ciclosporina. El certolizumab apenas cruza la placenta, aunque hay muy pocos datos sobre su teratogenicidad. El adalimumab, el etanercept y el infliximab son categoría B de la FDA. Con otros biológicos, apenas hay datos117.
Tratamiento de la psoriasis en localizaciones específicas
En este apartado comentaremos brevemente el tratamiento de la psoriasis ungueal y de la artritis psoriásica.
Tratamiento de la psoriasis ungueal
La psoriasis leve (1 o 2 uñas, sin afectación funcional ni síntomas significativos) puede tratarse con medicamentos tópicos, aunque existe una evidencia limitada de la eficacia. Es de elección el tratamiento combinado con corticoides de alta potencia y análogos de la vitamina D (1 vez al día) o, si no es posible, cualquiera de estos medicamentos en monoterapia. Si en 3-6 meses no mejora, puede probarse una segunda línea (tacrolimus o tazaroteno tópicos)118.
La psoriasis ungueal de moderada a grave (aquella que se asocia a distrofia importante de más de 2 uñas o que se asocia a síntomas o repercusión funcional significativos) se trata con medicamentos sistémicos, preferiblemente biológicos. Estos son los que presentan la mayor evidencia científica y los más efectivos. Biológicos eficaces para tratar la psoriasis ungueal son los siguientes: inhibidores del TNF α (infliximab, etanercept, adalimumab y certolizumab), ustekinumab, secukinumab, ixekizumab, guselkumab y risankizumab118. Como segunda línea, puede usarse metotrexato o apremilast75.
Tratamiento de la artritis psoriásica
El tratamiento debe individualizarse en función de diversos factores, como la actividad de la enfermedad, la presentación o las comorbilidades119.
Para tratar la artritis psoriásica con afectación periférica activa, las guías clínicas119–122 en general recomiendan fármacos modificadores de la enfermedad convencionales (como el metotrexato, de elección según la Sociedad Española de Reumatología), aunque explican que las terapias biológicas han demostrado mayor eficacia. Si fracasa, se recomienda un medicamento biológico, en general un inhibidor del TNF α120,121.
En los casos con afectación predominantemente axial, es de elección un medicamento biológico (en general, un inhibidor del TNF α o un inhibidor de la IL-17A)119,121,122.
En la artritis psoriásica con entesitis o dactilitis, las opciones sistémicas preferentes son los fármacos biológicos119,120,122.
Por su parte, las guías americanas sitúan los inhibidores del TNF α en la primera línea terapéutica, por delante del metotrexato y de otras moléculas pequeñas, tanto en los casos de artritis periférica como de afectación axial, entesitis y dactilitis120.
¿Cuál es el curso clínico de la psoriasis?
La evolución clínica de la psoriasis en un paciente concreto es impredecible1. La psoriasis en placas es una enfermedad crónica que cursa alternando brotes y remisiones durante un tiempo indefinido; puede durar toda la vida o también haber una remisión completa18. La gravedad a lo largo del tiempo es muy variable1. Las recidivas pueden ser más o menos intensas en una misma persona18.
La remisión comienza cuando las placas se vuelven pálidas. Pueden desaparecer por completo o, en algunos casos (sobre todo en codos y rodillas) persistir. Puede quedar hipo- o hiperpigmentación posinflamatoria definitiva18.
Aunque la psoriasis es una causa rara de mortalidad, esta es posible en las formas graves, por ejemplo, en la psoriasis eritrodérmica o pustulosa generalizada. Además, la psoriasis se asocia a un incremento de la mortalidad global y cardiovascular1.
Últimas guías publicadas
- Actualización práctica del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología para el tratamiento de la psoriasis con terapia biológica. Parte 1.
https://www.sciencedirect.com/science/article/pii/S000173102100380X
Carrascosa JM, Puig L, Belinchón Romero I, Salgado-Boquete L, del Alcázar E, Andrés Lencina JJ, et al. Actualización práctica de las recomendaciones del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPS) para el tratamiento de la psoriasis con terapia biológica. Parte 1. «Conceptos y manejo general de la psoriasis con terapia biológica». Actas Dermosifiliogr. 2022;113(3):261-77.
- Actualización práctica del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología para el tratamiento de la psoriasis con terapia biológica. Parte 2.
https://www.sciencedirect.com/science/article/pii/S0001731022001223
Carrascosa JM, Puig L, Belinchón Romero I, Salgado-Boquete L, del Alcázar E, Andrés Lencina JJ, et al. Actualización práctica de las recomendaciones del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPS) para el tratamiento de la psoriasis con terapia biológica. Parte 2 «Manejo de poblaciones especiales, pacientes con comorbilidad y gestión del riesgo». Actas Dermosifiliogr. 2022;113(6):583-609.
- Guía EuroGuiDerm para el tratamiento sistémico de la psoriasis vulgar. Parte 1.
https://pubmed.ncbi.nlm.nih.gov/33349983/
Nast A, Smith C, Spuls P, Ávila Valle G, Bata-Csörgö Z, Bogdanov I, et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris – Part 1: treatment and monitoring recommendations. J Eur Acad Dermatol Venereol. 2020;34(11):2461-2498.
- Guía EuroGuiDerm para el tratamiento sistémico de la psoriasis vulgar. Parte 2.
https://pubmed.ncbi.nlm.nih.gov/33547728/
EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris – Part 2: specific clinical and comorbid situations. J Eur Acad Dermatol Venereol. 2021. 35(2):281-317.
- Adaptación italiana de la Guía EuroGuiDerm para el tratamiento sistémico de la psoriasis en placas crónica.
https://pubmed.ncbi.nlm.nih.gov/35262308/
Gisondi P, Fargnoli MC, Amerio P, Argenziano G, Bardazzi F, Bianchi L, et al. Italian adaptation of EuroGuiDerm guideline on the systemic treatment of chronic plaque psoriasis. Ital J Dermatol Venerol. 2022;157(Suppl. 1 to No. 1):1-78.
- Documento de consenso del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología sobre la evaluación y tratamiento de la psoriasis de moderada a grave.
https://www.ncbi.nlm.nih.gov/pubmed/26812550
Daudén, E, Puig L, Ferrándiz C, Sánchez-Carazo J, Hernanz-Hermosa J; Spanish Psoriasis Group of the Spanish Academy of Dermatology and Venereology. Consensus document on the evaluation and treatment of moderate-to-severe psoriasis: Psoriasis Group of the Spanish Academy of Dermatology and Venereology. J Eur Acad Dermatol Venereol. 2016; 30: 1-18.
- Guía británica sobre el tratamiento de la psoriasis con medicamentos biológicos (2017).
https://www.ncbi.nlm.nih.gov/pubmed/28513835
Smith CH, Jabbar-Lopez ZK, Yiu ZZ, Bale T, Burden AD, Coates LC, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2017. Br J Dermatol. 2017; 177 (3): 628-636.
- Guía británica sobre el tratamiento de la psoriasis con medicamentos biológicos (actualización rápida 2020).
https://pubmed.ncbi.nlm.nih.gov/32189327/
Smith CH, Yiu ZZN, Bale T, Burden AD, Coates LC, Edwards W, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2020: a rapid update. Br J Dermatol. 2020;183(4):628-637.
- Guía de evaluación y tratamiento de la psoriasis del National Institute for Health and Care Excellence (NICE).
https://www.nice.org.uk/guidance/cg153
National Institute for Health and Care Excellence (NICE). Psoriasis: assessment and management. Clinical guideline [CG153]. NICE. 2012 [actualizado en 2017].
- Guía latinoamericana para el tratamiento sistémico de la psoriasis.
https://www.ncbi.nlm.nih.gov/pubmed/31282026
Kogan N, Raimondo N, Gusis SE, Izcovich A, Abarca Duran JA, Barahona-Torres L, et al. Latin American Clinical Practice Guidelines on the Systemic Treatment of Psoriasis SOLAPSO – Sociedad Latinoamericana de Psoriasis (Latin American Psoriasis Society). Int J Dermatol. 2019; 58 (Suppl 1): 4-28.
- Guía de práctica clínica para el tratamiento de la psoriasis en Colombia.
González Ardila CF, Londoño García AM, Cortés Correa CI (editores). Guía de práctica clínica para el tratamiento de la psoriasis en Colombia. Rev Asoc Colomb Dermatol. 2018; 26 (1): 1-257.
- Guía de práctica clínica para el tratamiento de la psoriasis en Colombia (actualización 2022).
https://revista.asocolderma.org.co/index.php/asocolderma/article/view/1719
Castro JR, Manuel A, Franco D, César F, González F, Ángela A, et al. Guía de práctica clínica para el tratamiento de la psoriasis en Colombia: actualización 2022. Revista de la Asociación Colombiana de Dermatología y Cirugía Dermatológica. 2022 .
- Guía francesa sobre el tratamiento sistémico de la psoriasis de moderada a grave en adultos.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6593704/
Amatore F, Villani AP, Tauber M, Viguier M, Guillot B; Psoriasis Research Group of the French Society of Dermatology. French guidelines on the use of systemic treatments for moderate-to-severe psoriasis in adults. JEADV. 2019; 33: 464-483.
- Guía de la Asociación Americana de Dermatología y la Fundación Nacional de Psoriasis para el tratamiento de la psoriasis, con atención a las enfermedades concomitantes.
https://www.jaad.org/article/S0190-9622(18)33002-0/fulltext
Elmets CA, Leonardi CL, Davis DMR, Gelfand JM, LichtenJ, Mehta NH, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with awareness and attention to comorbidities. J Am Acad Dermatol. 2019; 80 (4): 1073-1113.
- Guía de la Asociación Americana de Dermatología y la Fundación Nacional de Psoriasis para el tratamiento de la psoriasis con medicamentos biológicos.
https://www.jaad.org/article/S0190-9622(18)33001-9/fulltext
Menter A, Strober BE, Kaplan DH, Kivelevitch D, Farley Prater E, Stoff B, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol. 2019; 80 (4): 1029-1072.
- Guía de la Asociación Americana de Dermatología y la Fundación Nacional de Psoriasis para el tratamiento de la psoriasis con fototerapia.
https://www.jaad.org/article/S0190-9622(19)30637-1/fulltext
Elmets CA, Lim HW, Stoff B, Connor C, Cordoro KM, Lebwohl M, et al. Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis with phototherapy. J Am Acad Dermatol. 2019; 81 (3): 775-804.
- Guía de la Asociación Americana de Dermatología y la Fundación Nacional de Psoriasis para el tratamiento de la psoriasis en pacientes pediátricos.
https://www.jaad.org/article/S0190-9622(19)32655-6%20/fulltext
Elmets CA, Cordoro KM, Davis DMR, Kroshinsky D, Paller AS, Armstrong AW, et al. Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis in pediatric patients. J Am Acad Dermatol. 2019. pii: S0190-9622(19)32655-6.
- Tildrakizumab para el tratamiento de la psoriasis en placas de moderada a grave.
https://www.nice.org.uk/guidance/ta575
National Institute for Health and Care Excellence (NICE). Tildrakizumab for treating moderate to severe plaque psoriasis. Technology appraisal guidance [TA575]. 17 abr 2019.
- Guía de la Sociedad Española de Reumatología para el tratamiento de la espondiloartritis axial y la artritis psoriásica.
https://www.ser.es/wp-content/uploads/2016/03/ESPOGUIA-actualizaci%C3%B3n-2017_DEF_web.pdf
Sociedad Española de Reumatología. GPC para el tratamiento de la espondiloartritis axial y la artritis psoriásica. Actualización. 2018.
- Guías americanas para el tratamiento de la artritis psoriásica.
https://onlinelibrary.wiley.com/doi/full/10.1002/art.40726
Singh JA, Guyatt G, Ogdie A, Gladman DD, Deal C, Deodhar A, et al. Special Article: 2018 American College of Rheumatology/National Psoriasis Foundation Guideline for the Treatment of Psoriatic Arthritis. Arthritis Rheumatol. 2019; 71 (1): 5-32.
- Recomendaciones del Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) para el tratamiento de la artritis psoriásica.
https://pubmed.ncbi.nlm.nih.gov/35293339/
Coates LC, Corp N, van der Windt DA, O’Sullivan D, Soriano ER, Kavanaugh A. GRAPPA Treatment Recommendations: 2021 Update. J Rheumatol. 2022;49(6 Suppl 1):52-4.
- Guía británica para el tratamiento de la artritis psoriásica.
https://pubmed.ncbi.nlm.nih.gov/35640657/
Tucker L, Allen A, Chandler D, Ciurtin C, Dick A, Foulkes A, et al. The 2022 British Society for Rheumatology guideline for the treatment of psoriatic arthritis with biologic and targeted synthetic DMARDs. Rheumatology (Oxford) [Internet]. 2022 ago 30 [citado 2022 dic 14];61(9):e255-66.
- Consenso para la recategorización de la gravedad de la psoriasis, del International Psoriasis Council: Guía de bolsillo de la Fundación Nacional de Psoriasis sobre la psoriasis y la artritis psoriásica.
https://www.jaad.org/article/S0190-9622(19)32573-3/fulltext
Strober B, Ryan C, van de Kerkhof P, van der Walt J, Kimball AB, Barker J, Blauvelt A; International Psoriasis Council Board Members and Councilors. Recategorization of psoriasis severity: Delphi consensus from the International Psoriasis Council. J Am Acad Dermatol. 2019; pii: S0190-9622(19)32573-3.
- Guía americana para el tratamiento de la psoriasis con tratamiento tópico y terapias alternativas.
https://pubmed.ncbi.nlm.nih.gov/32738429/
Elmets CA, Korman NJ, Prater EF, Wong EB, Rupani RN, Kivelevitch D, et al. Joint AAD-NPF Guidelines of care for the management and treatment of psoriasis with topical therapy and alternative medicine modalities for psoriasis severity measures. J Am Acad Dermatol. 2021;84(2):432-70.
Recursos relacionados
- Consulta rápida: Tratamiento tópico de la psoriasis
- Consulta rápida: Cómo mejorar la adherencia al tratamiento tópico de la psoriasis
- Consulta rápida: Cómo mejorar la calidad de vida del paciente con psoriasis
- Actualización: Evaluación y tratamiento del prurito en la psoriasis
- Actualización: Psoriasis y salud mental: un enfoque práctico
- Consulta rápida: Papel del dermatólogo en el abordaje de las enfermedades digestivas asociadas a la psoriasis
- Consulta rápida: Tratamiento de la psoriasis con biológicos en pacientes con comorbilidades
- Consulta rápida: El dermatólogo en el abordaje de las enfermedades CV en los pacientes con psoriasis
Recursos en línea y apps para médicos
Herramientas interactivas
- Calculadora PASI de la Asociación Española de Dermatología y Venereología
Recursos en línea y apps para médicos
Existen muchos recursos en Internet sobre la psoriasis. Algunos presentan la patología como parte de un abanico más amplio de patologías dermatológicas, y otros tratan solo la psoriasis.
Recursos relacionados
- Sección: Webs y apps para médicos
Webs de dermatología y psoriasis para médicos
Academia Española de Dermatología y Venereología (AEDV)
La web oficial de la Academia Española de Dermatología y Venerología (AEDV) proporciona información sobre el Congreso Nacional AEVD y otras reuniones y eventos de dermatología.
European Dermatology Forum (EDF)
Es el sitio web de una organización sin ánimo de lucro dedicada a mejorar el estado de esta especialidad médica a nivel europeo. Aquí se pueden encontrar y descargar las guías clínicas europeas vigentes, incluidas las de psoriasis.
American Academy of Dermatology (AAD)
Es el sitio web de la asociación de dermatólogos más numerosa y representativa de Estados Unidos (en inglés). Para los profesionales hay una sección que recoge las guías clínicas vigentes, además de otros recursos interesantes.
International Psoriasis Council IPC
Una red de más de 100 expertos en psoriasis cuyo objetivo es difundir el conocimiento sobre la enfermedad. Entre otros recursos, contiene enlaces a las guías clínicas de abordaje de la psoriasis de diferentes países, a publicaciones (algunas de acceso libre) en diferentes formatos (vídeos, artículos, etc.) o a herramientas para diagnosticar la gravedad de la psoriasis (como el PASI, el DLQI o el PGA). La página web está en inglés.
Biobadaderm: Registro español de tratamientos sistémicos en psoriasis
Sitio web promovido por la Fundación de la Academia Española de Dermatología y Venereología (FAEDV), en colaboración con otras instituciones, como estrategia de farmacovigilancia en pacientes psoriásicos. Forma parte de la Psonet, una red europea para compartir datos procedentes de registros de pacientes tratados con fármacos biológicos. Incluye las últimas publicaciones.
Apps de dermatología para médicos
Skin Assistance Modelling (SAM)
Nueva aplicación del área de la salud, desarrollada por Almirall, por y para la comunidad dermatológica global.
Calculadora SM-PsO
La asociación epidemiológica entre la psoriasis y el síndrome metabólico, con un aumento del riesgo cardiovascular, se conoce desde hace tiempo. La Calculadora SM-PsO es una aplicación que ayuda a determinar si el paciente con psoriasis presenta los indicadores de síndrome metabólico, así como a estimar el riesgo cardiovascular mediante las tablas REGICOR. Se incluyen recomendaciones en función de los resultados.
Disponible en inglés para dispositivos con sistema Android.
DLQI
Esta es la aplicación oficial del índice de calidad de vida en dermatología (DLQI), creada por la Universidad de Cardiff.
Disponible en español para dispositivos con sistema Android e IOS.
Información para pacientes
Descargar en PDF los Consejos para pacientes con psoriasis
Introducción
La psoriasis es una enfermedad crónica que, en muchos casos, tiene repercusiones estéticas importantes.
Un 2,3 % de los pacientes españoles tiene psoriasis; esta prevalencia aumenta con la edad, con mayor presencia de la enfermedad entre los 40 y los 70 años.
Los tratamientos existentes no son curativos, sino que están dirigidos a controlar los síntomas y a prevenir
complicaciones. Por otra parte, las medidas higiénicodietéticas son un punto fundamental en el paciente con psoriasis para mantener la piel en el mejor estado posible.
¿Qué es la psoriasis?
La psoriasis es una enfermedad inflamatoria que afecta principalmente a la piel, aunque también puede afectar a otros órganos. Existe una predisposición genética a sufrir la enfermedad.
Las lesiones típicas de la psoriasis consisten en placas secas, elevadas y enrojecidas, con la superficie de aspecto escamoso y de color blanco plateado. Este tipo de lesiones puede aparecer en cualquier lugar del cuerpo, como codos, rodillas, cuero cabelludo y parte baja de la espalda, principalmente. Según su presentación, se distinguen diversas variantes de la psoriasis; la más frecuente es la llamada psoriasis vulgar o psoriasis en placas.
No se conoce la causa de la psoriasis, aunque se cree que se trata de un problema del sistema inmunitario que hace que la piel se regenere a un ritmo más rápido de lo normal. En los pacientes genéticamente susceptibles, la exposición a factores como infecciones, un clima frío y seco, ciertos fármacos, lesiones en la piel o estrés, entre otros, puede desencadenar la enfermedad.
En general, si se sufre de psoriasis, hay que consultar al médico:
- cuando aparezcan nuevas lesiones o las lesiones ya existentes no mejoren con el tratamiento prescrito o empeoren;
- en caso de que aparezcan efectos adversos al tratamiento prescrito por el médico;
- en caso de dolor o inflamación de las articulaciones.
¿Se puede prevenir la psoriasis?
No se conoce ninguna forma de prevenir la psoriasis. En los pacientes con psoriasis, se recomienda evitar la exposición a factores desencadenantes y mantener la piel hidratada y en estado óptimo para reducir los brotes.
En general, se recomiendan las medidas higiénico-dietéticas siguientes:
- Aseo personal. Bañarse a diario usando agua tibia y jabones suaves con aceites y grasas añadidas; evitar friccionar la piel.
- Alimentación. Seguir una dieta sana y equilibrada, evitando el consumo de alcohol.
- Sol. Exponer la piel a pequeñas cantidades de luz solar, evitando quemarse utilizando protección solar
- Hidratación. Mantener la piel y las lesiones adecuadamente hidratadas. Para ello, aplicarse
crema humectante después de bañarse y secarse, mientras la piel aún esté húmeda. - Situaciones de estrés. Evitar situaciones que puedan desencadenar estrés, ansiedad y depresión. El ejercicio físico contribuye a cumplir este objetivo.
¿En qué consiste el tratamiento de la psoriasis?
El tratamiento de la psoriasis depende de su gravedad y de las zonas de piel afectadas, así como de la respuesta a tratamientos anteriores. El médico puede recetarte productos con o sin agentes farmacológicos para aplicarte en la piel (p. ej., cremas o champús), medicamentos o bien fototerapia (que consiste en el uso de la luz ultravioleta para tratar la psoriasis).
En cualquier caso, es importante seguir el tratamiento tal como lo ha recetado el médico y consultarle cualquier duda que surja al respecto.
Por último, las medidas higiénico-dietéticas preventivas antes mencionadas también son aplicables a pacientes que tienen psoriasis, independientemente de la gravedad de la enfermedad.
Recursos en PDF para los pacientes
- Infografías y folletos para pacientes: Psoriasis: infografía para pacientes
- Infografías y folletos para pacientes: Psoriasis: preguntas frecuentes de los pacientes
- Infografías y folletos para pacientes: Guía de hábitos saludables para los pacientes con psoriasis
- Infografías y folletos para pacientes: Skilarence: folleto informativo
- Guía para pacientes con psoriasis, de la Academia Española de Dermatología y Venereología
Recursos en línea y apps para pacientes
El consejo del médico puede completarse recomendando webs y apps que sirvan a los pacientes para mejorar la información que tienen sobre la psoriasis, así como para apoyarlos en el cambio de los hábitos de vida.
Recursos relacionados
- Sección: Webs y apps para pacientes
Webs de dermatología y psoriasis para pacientes
La Academia Española de Dermatología y Venereología (AEDV) tiene una fundación asociada, la Fundación Piel Sana, dedicada a la difusión de conocimiento con información útil y actualizada para los pacientes.
Su buscador permite obtener multitud de información relacionada con la psoriasis y contenidos útiles para los pacientes.
Asociación de pacientes creada por pacientes de psoriasis y artritis psoriásica y familiares, que está asociada a su vez a Europso (Federation of European Psoriasis Associations) y a IFPA (International Federation of Psoriasis Associations). Contiene gran cantidad de información acerca de la enfermedad, incluidos una guía completa sobre el tratamiento y vídeos con testimonios y consejos.
Es una asociación creada por pacientes de psoriasis y artritis psoriásica para informar, defender y dar apoyo a los pacientes. En el apartado La psoriasis que no se ve se explican los tipos de psoriasis y la relación de la psoriasis con otras enfermedades. Contiene también, entre otros recursos, una sección de noticias con consejos para los pacientes y novedades.
Organización estadounidense sin ánimo de lucro dirigida a fomentar la investigación y proporcionar mejores cuidados en psoriasis y artritis psoriásica. Tienen una versión en español con información para los pacientes y un blog con las últimas novedades.Apps de dermatología y psoriasis para pacientes
Apps de dermatología y psoriasis para pacientes
Psoriasis Deep Dive
Una experiencia visual para conocer la psoriasis. Recrea en tres dimensiones la epidermis del paciente con psoriasis, para comprender los diferentes estadios de la enfermedad. Está en inglés, pero es tan visual que es muy sencilla de usar.
Disponible en inglés para dispositivos con sistema IOS.
Bibliografía
- Feldman SR. Psoriasis: Epidemiology, clinical manifestations, and diagnosis [Internet]. UpToDate. 2022 [citado 2022 oct 13]. Disponible en: https://www.uptodate.com/contents/psoriasis-epidemiology-clinical-manifestations-and-diagnosis
- Korman N. Comorbid disease in psoriasis [Internet]. UpToDate. 2022 [citado 2022 oct 13]. Disponible en: https://www.uptodate.com/contents/comorbid-disease-in-psoriasis
- Michalek IM, Loring B, John SM. A systematic review of worldwide epidemiology of psoriasis. J Eur Acad Dermatol Venereol [Internet]. 2017 [citado 2022 oct 13];31(2):205-12. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27573025/
- Greb JE, Goldminz AM, Elder JT, Lebwohl MG, Gladman DD, Wu JJ, et al. Psoriasis. Nat Rev Dis Primers [Internet]. 2016 [citado 2022 oct 13];2. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27883001/
- World Health Organization. Global report on psoriasis. Suiza; 2016.
- Parisi R, Iskandar IYK, Kontopantelis E, Augustin M, Griffiths CEM, Ashcroft DM. National, regional, and worldwide epidemiology of psoriasis: systematic analysis and modelling study. The BMJ [Internet]. 2020 [citado 2022 oct 13];369. Disponible en: https://www.bmj.com/content/369/bmj.m1590
- Ferrándiz C, Carrascosa JM, Toro M. Prevalencia de la psoriasis en España en la era de los agentes biológicos. Actas Dermosifiliogr [Internet]. 2014 [citado 2022 oct 13];105(5):504-9. Disponible en: https://www.actasdermo.org/es-prevalencia-psoriasis-espana-era-agentes-articulo-S0001731014000180
- Puig L, Ruiz De Morales JG, Dauden E, Andreu JL, Cervera R, Adán A. La prevalencia de 10 enfermedades inflamatorias inmunomediadas (IMID) en España. Rev Esp Salud Pública. 2019;93(2):e1-19.
- Boehncke WH, Schön MP. Psoriasis. Lancet [Internet]. 2015 [citado 2022 oct 14];386(9997):983-94. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26025581/
- Van De Kerkhof PCM, Nestlé FO. Psoriasis. En: Bolognia JL, Schaffer J V, Cerroni L, editores. Dermatologia. 4.a ed. Barcelona: Elsevier; 2018. p. 138-60.
- Rousset L, Halioua B. Stress and psoriasis. Int J Dermatol. 2018;57(10):1165-72.
- Stewart TJ, Tong W, Whitfeld MJ. The associations between psychological stress and psoriasis: a systematic review. Int J Dermatol. 2018;57(11):1275-82.
- Snast I, Reiter O, Atzmony L, Leshem YA, Hodak E, Mimouni D, et al. Psychological stress and psoriasis: a systematic review and meta-analysis. Br J Dermatol. 2018;178(5):1044-55.
- National Psoriasis Foundation. Psoriasis: Causes & Triggers: National Psoriasis Foundation [Internet]. 2021 [citado 2022 oct 14]. Disponible en: https://www.psoriasis.org/causes/
- Blauvelt A, Ehst BD. Pathophysiology of plaque psoriasis [Internet]. UpToDate. 2022 [citado 2022 oct 14]. Disponible en: https://www.uptodate.com/contents/pathophysiology-of-plaque-psoriasis
- Mehlis S. Guttate psoriasis [Internet]. UpToDate. 2022 [citado 2022 oct 14]. Disponible en: https://www.uptodate.com/contents/guttate-psoriasis
- Kalb RE. Pustular psoriasis: Pathogenesis, clinical manifestations, and diagnosis [Internet]. UpToDate. 2022 [citado 2022 oct 14]. Disponible en: https://www.uptodate.com/contents/pustular-psoriasis-pathogenesis-clinical-manifestations-and-diagnosis
- Du-Thanh A, Jullien D, Girard C. Psoriasis. EMC – Dermatología [Internet]. 2013 [citado 2022 oct 14];47(4):1-21. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1761289613659646
- Bournerias I. Psoriasis. EMC – Tratado de Medicina. 2014;18(3):1-10.
- Machado-Pinto J, Diniz M dos S, Bavoso NC. Psoriasis: new comorbidities. An Bras Dermatol. 2016;91(1):8.
- Daudén E, Castañeda S, Suárez C, García-Campayo J, Blasco AJ, Aguilar MD, et al. Abordaje integral de la comorbilidad del paciente con psoriasis. Actas Dermosifiliogr [Internet]. 2012 [citado 2022 oct 17];103:1-64. Disponible en: https://www.actasdermo.org/es-abordaje-integral-comorbilidad-del-paciente-articulo-S0001731012700017
- Bu J, Ding R, Zhou L, Chen X, Shen E. Epidemiology of Psoriasis and Comorbid Diseases: A Narrative Review. Front Immunol. 2022;13:2484.
- Pouw JN, Jacobs ME, Balak DMW, Van Laar JM, Welsing PMJ, Leijten EFA. Do Patients with Psoriatic Arthritis Have More Severe Skin Disease than Patients with Psoriasis Only? A Systematic Review and Meta-Analysis. Dermatology. 2022;
- Gladman DD, Ritchlin C. Clinical manifestations and diagnosis of psoriatic arthritis [Internet]. UpToDate. 2022 [citado 2022 oct 17]. Disponible en: https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-psoriatic-arthritis
- Turrión Nieves A, Martín Holguera R, Movasat Hadjkan A, Bohórquez Heras C, Álvarez de Mon Soto M. Artritis psoriásica. Medicine. 2017;12(26):1508-19.
- Loganathan A, Kamalaraj N, El-Haddad C, Pile K. Systematic review and meta-analysis on prevalence of metabolic syndrome in psoriatic arthritis, rheumatoid arthritis and psoriasis. Int J Rheum Dis. 2021;24(9):1112-20.
- Ko SH, Chi CC, Yeh ML, Wang SH, Tsai YS, Hsu MY. Lifestyle changes for treating psoriasis. Cochrane Database Syst Rev. 2019;7(7).
- Wu MY, Yu CL, Yang SJ, Chi CC. Change in body weight and body mass index in psoriasis patients receiving biologics: A systematic review and network meta-analysis. J Am Acad Dermatol. 2020;82(1):101-9.
- Song G, Yoon HY, Yee J, Kim MG, Gwak HS. Antihypertensive drug use and psoriasis: A systematic review, meta- and network meta-analysis. Br J Clin Pharmacol. 2022;88(3):933-41.
- Fu Y, Lee CH, Chi CC. Association of Psoriasis With Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. JAMA Dermatol. 2018;154(12):1417-27.
- EASL-EASD-EASO. Guía de práctica clínica de la EASL-EASD-EASO para el tratamiento de la enfermedad por hígado graso no alcohólico. J Hepatol. 2016;65(2):386-98.
- Candia R, Ruiz A, Torres-Robles R, Chávez-Tapia N, Méndez-Sánchez N, Arrese M. Risk of non-alcoholic fatty liver disease in patients with psoriasis: a systematic review and meta-analysis. Journal of the European Academy of Dermatology and Venereology. 2015;29(4):656-62.
- Vaengebjerg S, Skov L, Egeberg A, Loft ND. Prevalence, Incidence, and Risk of Cancer in Patients With Psoriasis and Psoriatic Arthritis: A Systematic Review and Meta-analysis. JAMA Dermatol. 2020;156(4):421-9.
- Meng Y, Zeng F, Sun H, Li Y, Chen X, Deng G. Clinical characteristics and outcomes of patients with COVID-19 and psoriasis. J Med Virol. 2022;94(12).
- Yan D, Kolla AM, Young T, Fried L, Shankar S, Rangel L, et al. COVID-19 outcomes in patients with psoriasis and psoriatic arthritis: A prospective cohort study. JAAD Int. 2022;8:31.
- Aram K, Patil A, Goldust M, Rajabi F. COVID-19 and exacerbation of dermatological diseases: A review of the available literature. Dermatol Ther. 2021;34(6).
- Campanati A, Diotallevi F, Martina E, Radi G, Offidani A. Treatment of Moderate to Severe Psoriasis during the COVID-19 Pandemic: Lessons Learned and Opportunities. J Clin Med. 2022;11(9).
- Wu PC, Huang IH, Wang CW, Tsai CC, Chung WH, Chen CB. New Onset and Exacerbations of Psoriasis Following COVID-19 Vaccines: A Systematic Review. Am J Clin Dermatol. 2022;23(6).
- Elmets CA, Leonardi CL, Davis DMR, Gelfand JM, Lichten J, Mehta NN, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with awareness and attention to comorbidities. J Am Acad Dermatol. 2019;80(4):1073-113.
- National Institute for Health and Care Excellence (NICE). Psoriasis: assessment and management | Guidance | NICE [Internet]. 2012 [citado 2022 oct 21]. Disponible en: https://www.nice.org.uk/guidance/cg153
- Grupo de Trabajo de Psoriasis de la Academia Española de Dermatología y Venereología (AEDV). ¿Cómo se mide la gravedad de la psoriasis? Principales índices. 2016.
- Martin G, Young M, Aldredge L. Recommendations for Initiating Systemic Therapy in Patients with Psoriasis. J Clin Aesthet Dermatol [Internet]. 2019 [citado 2022 oct 26];12(4):13. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31119006/
- Cabanela López JM, Miguel Carrera J, López Peón M. Quemaduras. Guías clínicas Fisterra. 2019.
- González Ardila CF, Londoño García ÁM, Cortés Correa CI. Guía de práctica clínica para el tratamiento de la psoriasis en Colombia. Revista de la Asociación Colombiana de Dermatología y Cirugía Dermatológica [Internet]. 2020 [citado 2022 oct 21]; Disponible en: https://revista.asocolderma.org.co/index.php/asocolderma/article/view/1507
- Carrascosa JM, Puig L, Belinchón Romero I, Salgado-Boquete L, del Alcázar E, Andrés Lencina JJ, et al. Actualización práctica de las recomendaciones del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPS) para el tratamiento de la psoriasis con terapia biológica. Parte 1. «Conceptos y manejo general de la psoriasis con terapia biológica». Actas Dermosifiliogr. 2022;113(3):261-77.
- Basra MKA, Fenech R, Gatt RM, Salek MS, Finlay AY. The Dermatology Life Quality Index 1994-2007: a comprehensive review of validation data and clinical results. Br J Dermatol. 2008;159(5):997-1035.
- Amatore F, Villani AP, Tauber M, Viguier M, Guillot B. French guidelines on the use of systemic treatments for moderate-to-severe psoriasis in adults. J Eur Acad Dermatol Venereol [Internet]. 2019 [citado 2022 oct 28];33(3):464-83. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30793796/
- Kolios AGA, Yawalkar N, Anliker M, Boehncke WH, Borradori L, Conrad C, et al. Swiss S1 Guidelines on the Systemic Treatment of Psoriasis Vulgaris. Dermatology. 2016;232(4):385-406.
- Gisondi P, Fargnoli MC, Amerio P, Argenziano G, Bardazzi F, Bianchi L, et al. Italian adaptation of EuroGuiDerm guideline on the systemic treatment of chronic plaque psoriasis. Italian journal of dermatology and venereology [Internet]. 2022 [citado 2022 oct 28];157(Suppl. 1 to No. 1):1-78. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35262308/
- Gisondi P, Altomare G, Ayala F, Bardazzi F, Bianchi L, Chiricozzi A, et al. Italian guidelines on the systemic treatments of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 2017;31(5):774-90.
- Nast A, Smith C, Spuls P, Ávila VAlle G, Bata-Csörgö Z, Bogdanov I, et al. EuroGuiDerm Guideline for the systemic treatment of psoriasis vulgaris. 2022.
- Lim WL, How CH, Tan KW. Management of psoriasis in primary care. Singapore Med J [Internet]. 2021 [citado 2022 oct 28];62(3):109. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33846752/
- Ballester Torrens M del M, Senán Sanz R, Ferran Farres M, Barcala del Cano F. Terapia tópica de la psoriasis en Atención Primaria [Internet]. Sociedad Española de Medicina de Familia y Comunitaria. 2011 [citado 2022 oct 28]. Disponible en: https://www.semfyc.es/wp-content/uploads/2017/02/Cuaderno_Asistente_Psoriasis.pdf
- Menter A, Gelfand JM, Connor C, Armstrong AW, Cordoro KM, Davis DMR, et al. Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management of psoriasis with systemic nonbiologic therapies. J Am Acad Dermatol [Internet]. 2020 [citado 2022 oct 28];82(6):1445-86. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32119894/
- Daudén E, Puig L, Ferrándiz C, Sánchez-Carazo JL, Hernanz-Hermosa JM. Consensus document on the evaluation and treatment of moderate-to-severe psoriasis: Psoriasis Group of the Spanish Academy of Dermatology and Venereology. J Eur Acad Dermatol Venereol [Internet]. 2016 [citado 2022 oct 31];30 Suppl 2:1-18. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26812550/
- Mrowietz U, Kragballe K, Reich K, Spuls P, Griffiths CEM, Nast A, et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res. 2011;303(1):1-10.
- Menter A, Strober BE, Kaplan DH, Kivelevitch D, Prater EF, Stoff B, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol [Internet]. 2019 [citado 2022 oct 31];80(4):1029-72. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30772098/
- Strober B, Ryan C, van de Kerkhof P, van der Walt J, Kimball AB, Barker J, et al. Recategorization of psoriasis severity: Delphi consensus from the International Psoriasis Council. J Am Acad Dermatol. 2020;82(1):117-22.
- Salgado-Boquete L, Carrascosa JM, Llamas-Velasco M, Ruiz-Villaverde R, de la Cueva P, Belinchón I. A New Classification of the Severity of Psoriasis: What’s Moderate Psoriasis? Life 2021, Vol 11, Page 627. 2021;11(7):627.
- Feldman SR. Treatment of psoriasis in adults [Internet]. UpToDate. 2022 [citado 2022 oct 31]. Disponible en: https://www.uptodate.com/contents/treatment-of-psoriasis-in-adults
- Elmets CA, Korman NJ, Prater EF, Wong EB, Rupani RN, Kivelevitch D, et al. Joint AAD-NPF Guidelines of care for the management and treatment of psoriasis with topical therapy and alternative medicine modalities for psoriasis severity measures. J Am Acad Dermatol [Internet]. 2021 [citado 2022 oct 31];84(2):432-70. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32738429/
- Palomar Llatas F. Psoriasis y sus cuidados. Enfermería dermatológica. 2009;6:16-23.
- Ballester MM, Ribera M, Grupo de Dermatología de CAMFiC, Grupo de Cirugía Menor y Dermatología de la semFYC. Tratamiento tópico de la psoriasis en atención primaria [Internet]. Fundación de Atención Primaria. 2015 [citado 2022 oct 31]. Disponible en: https://www.semfyc.es/wp-content/uploads/2016/05/Psoriasis_2015.pdf
- Ford AR, Siegel M, Bagel J, Cordoro KM, Garg A, Gottlieb A, et al. Dietary Recommendations for Adults With Psoriasis or Psoriatic Arthritis From the Medical Board of the National Psoriasis Foundation: A Systematic Review. JAMA Dermatol. 2018;154(8):934-50.
- Kleyn EC, Morsman E, Griffin L, Wu JJ, Cm van de Kerkhof P, Gulliver W, et al. Review of international psoriasis guidelines for the treatment of psoriasis: recommendations for topical corticosteroid treatments. J Dermatolog Treat [Internet]. 2019 [citado 2022 nov 2];30(4):311-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31138038/
- Montes Gómez E, Castellano Cabrera JL, Plasencia Núñez M, Calzado Gómez G, Betancor García T, Carretero Hernández G. Uso adecuado de corticoides tópicos dermatológicos. Boletín Canario de Uso Racional del Medicamento del SCS [Internet]. 2017 [citado 2021 oct 29];8(4). Disponible en: https://www3.gobiernodecanarias.org/sanidad/scs/content/73457fa1-266b-11e7-bc4e-19616096e1db/BOLCAN_vol8_n4_MAR_2017_Corticoides_top_derma.pdf
- Sabaté LR, Diego L, Díez C, Pellicer À. Uso seguro de medicamentos tópicos I: corticosteroides. FMC [Internet]. 2022 [citado 2022 nov 2];29(2):94-100. Disponible en: https://www.fmc.es/es-uso-seguro-medicamentos-topicos-i-articulo-S1134207221002462
- Pinter A, Green LJ, Selmer J, Praestegaard M, Gold LS, Augustin M. A pooled analysis of randomized, controlled, phase 3 trials investigating the efficacy and safety of a novel, fixed dose calcipotriene and betamethasone dipropionate cream for the topical treatment of plaque psoriasis. Journal of the European Academy of Dermatology and Venereology. 2022;36(2):228-36.
- Armstrong A, Pinter A, Selmer J, Præstegaard M, Reich A, Koo J. Pooled Analysis Demonstrating Superior Patient- Reported Psoriasis Treatment Outcomes for Calcipotriene/ Betamethasone Dipropionate Cream Versus Suspension/Gel. J Drugs Dermatol. 2022;21(3):242-8.
- Segaert S, Calzavara-Pinton P, de la Cueva P, Jalili A, Lons Danic D, Pink AE, et al. Long-term topical management of psoriasis: the road ahead. J Dermatolog Treat [Internet]. 2022 [citado 2022 nov 2];33(1):111-20. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32091278/
- Carrascosa JM, Theng C, Thaçi D. Spotlight on Topical Long-Term Management of Plaque Psoriasis. Clin Cosmet Investig Dermatol [Internet]. 2020;13:495-8. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7397561/
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica tacrolimus [Internet]. 2021 [citado 2022 nov 21]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/02201001/FT_02201001.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica pimecrolimus [Internet]. [citado 2022 nov 21]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/65029/FT_65029.html
- Palacios Martínez D, Doria Carlin NA, Heras Hitos JA, Ramos Lledó E, Rodríguez Coronilla R. Psoriasis. Guía rápida actualizada [Internet]. Documentos clínicos Semergen. Madrid: SANED; 2022 [citado 2022 nov 22]. Disponible en: https://acortar.link/JClPq1
- Maul JT, Anzengruber F, Conrad C, Cozzio A, Häusermann P, Jalili A, et al. Topical Treatment of Psoriasis Vulgaris: The Swiss Treatment Pathway. Dermatology [Internet]. 2021 [citado 2022 nov 23];237(2):166-78. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33406520/
- Lebwohl M, Thaçi D, Warren RB. Addressing challenges associated with long-term topical treatment and benefits of proactive management in patients with psoriasis. J Eur Acad Dermatol Venereol [Internet]. 2021 [citado 2022 nov 23];35 Suppl 1(Suppl 1):35-41. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33619776/
- Chat VS, Uppal SK, Kearns DG, Han G, Wu JJ. Translating the 2019 AAD-NPF Guidelines of Care for Psoriasis With Attention to Comorbidities. Cutis [Internet]. 2021 [citado 2022 nov 23];108(2S):E1-2. Disponible en: https://pubmed.ncbi.nlm.nih.gov/34662273/
- Mosca M, Hong J, Hadeler E, Brownstone N, Bhutani T, Liao W. Scalp Psoriasis: A Literature Review of Effective Therapies and Updated Recommendations for Practical Management. Dermatol Ther (Heidelb) [Internet]. 2021 [citado 2022 nov 8];11(3):769. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33893995/
- Hong JJ, Mosca ML, Hadeler EK, Brownstone ND, Bhutani T, Liao WJ. Genital and Inverse/Intertriginous Psoriasis: An Updated Review of Therapies and Recommendations for Practical Management. Dermatol Ther (Heidelb) [Internet]. 2021 [citado 2022 nov 23];11(3):833-44. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33914293/
- Elmets CA, Lim HW, Stoff B, Connor C, Cordoro KM, Lebwohl M, et al. Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis with phototherapy. J Am Acad Dermatol [Internet]. 2019 [citado 2022 nov 25];81(3):775-804. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31351884/
- Smith CH, Yiu ZZN, Bale T, Burden AD, Coates LC, Edwards W, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2020: a rapid update. Br J Dermatol [Internet]. 2020 [citado 2022 nov 28];183(4):628-37. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32189327/
- Kogan N, Raimondo N, Gusis SE, Izcovich A, Abarca Duran JA, Barahona-Torres L, et al. Latin American Clinical Practice Guidelines on the Systemic Treatment of Psoriasis SOLAPSO – Sociedad Latinoamericana de Psoriasis (Latin American Psoriasis Society). Int J Dermatol [Internet]. 2019 [citado 2022 nov 28];58 Suppl 1(S1):4-28. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31282026/
- Castro JR, Manuel A, Franco D, César F, González F, Ángela A, et al. Guía de práctica clínica para el tratamiento de la psoriasis en Colombia: ACTUALIZACIÓN 2022. Revista de la Asociación Colombiana de Dermatología y Cirugía Dermatológica [Internet]. 2022 [citado 2022 oct 21]; Disponible en: https://revista.asocolderma.org.co/index.php/asocolderma/article/view/1719
- Sbidian E, Chaimani A, Garcia-Doval I, Doney L, Dressler C, Hua C, et al. Systemic pharmacological treatments for chronic plaque psoriasis: a network meta-analysis. Cochrane Database of Systematic Reviews [Internet]. 2022 [citado 2022 nov 28];2022(5). Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011535.pub5/full
- Armstrong AW, Siegel MP, Bagel J, Boh EE, Buell M, Cooper KD, et al. From the Medical Board of the National Psoriasis Foundation: Treatment targets for plaque psoriasis. J Am Acad Dermatol [Internet]. 2017 [citado 2022 nov 28];76(2):290-8. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27908543/
- Chat VS, Uppal SK, Kearns DG, Han G, Wu JJ. Translating the 2020 AAD-NPF Guidelines of Care for the Management of Psoriasis With Systemic Nonbiologics to Clinical Practice. Cutis [Internet]. 2021 [citado 2022 nov 28];107(2):99-103. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33891841/
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica metotrexato [Internet]. 2022 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/79580/FT_79580.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica metotrexato [Internet]. 2022 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/85482/FT_85482.html#4-8-reacciones-adversas
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica acitretina [Internet]. 2020 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/74727/FT_74727.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica ciclosporina [Internet]. 2022 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/60320/FT_60320.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica apremilast [Internet]. 2019 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/114981001/FT_114981001.html#9-fecha-de-la-primera-autorizaci-n-renovaci-n-de-la-autorizaci-n
- Mrowietz U, Barker J, Boehncke WH, Iversen L, Kirby B, Naldi L, et al. Clinical use of dimethyl fumarate in moderate-to-severe plaque-type psoriasis: a European expert consensus. J Eur Acad Dermatol Venereol [Internet]. 2018 [citado 2022 nov 28];32 Suppl 3:3-14. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30238510/
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica dimetilfumarato [Internet]. 2017 [citado 2022 nov 28]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1171201004/FT_1171201004.html
- Leonardi-Bee J, Drucker AM. Systemic treatments for psoriasis: not another network meta-analysis! Br J Dermatol [Internet]. 2022 [citado 2022 dic 12];187(1):3-4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35506185/
- Guelimi R, Afach S, Régnaux JP, Bettuzzi T, Chaby G, Sbidian E, et al. Overlapping network meta-analyses on psoriasis systemic treatments, an overview: quantity does not make quality. Br J Dermatol [Internet]. 2022 [citado 2022 dic 12];187(1):29-41. Disponible en: https://pubmed.ncbi.nlm.nih.gov/34854074/
- Howells L, Page MJ, Williams HC. «Quantity does not make quality»: when is there a case for repeating a network meta-analysis? Br J Dermatol [Internet]. 2022 [citado 2022 dic 12];186(5):911-3. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35080030/
- Leonardi CL, See K, Burge R, Sun Z, Zhang Y, Mallbris L, et al. Number Needed to Treat Network Meta-Analysis to Compare Biologic Drugs for Moderate-to-Severe Psoriasis. Adv Ther [Internet]. 2022 [citado 2022 dic 12];39(5):2256-69. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35316500/
- Armstrong AW, Soliman AM, Betts KA, Wang Y, Gao Y, Puig L, et al. Comparative Efficacy and Relative Ranking of Biologics and Oral Therapies for Moderate-to-Severe Plaque Psoriasis: A Network Meta-analysis. Dermatol Ther (Heidelb) [Internet]. 2021 [citado 2022 dic 12];11(3):885-905. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33788177/
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica golimumab [Internet]. 2014 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/109546005/FT_109546005.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica etanercept [Internet]. 2010 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/99126013/FT_99126013.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica adalimumab [Internet]. 2008 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/103256017/FT_103256017.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica certolizumab [Internet]. 2014 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/109544005/FichaTecnica_109544005.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica infliximab [Internet]. 2009 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/99116001/FT_99116001.html
- Papp K, Gulliver W, Lynde C, Poulin Y, Ashkenas J. Canadian guidelines for the management of plaque psoriasis: overview. J Cutan Med Surg [Internet]. 2011 [citado 2022 dic 12];15(4):210-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21781627/
- Gisondi P, Geat D, Pizzolato M, Girolomoni G. State of the art and pharmacological pipeline of biologics for chronic plaque psoriasis. Curr Opin Pharmacol [Internet]. 2019 [citado 2022 dic 12];46:90-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31212119/
- Janssen. Aspectos destacados de la información de prescripción: Stelara (ustekinumab) [Internet]. 2022 [citado 2022 dic 12]. Disponible en: https://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/STELARA-pi-es.pdf
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica ustekinumab [Internet]. 2013 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/detalle.html?nregistro=08494003
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica secukinumab [Internet]. 2019 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/detalle.html?nregistro=114980010
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica brodalumab [Internet]. 2017 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/lista.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica ixekizumab [Internet]. 2020 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/lista.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica bimekizumab [Internet]. 2021 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/detalle.html?nregistro=1211575002
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica risankizumab [Internet]. 2021 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/lista.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica guselkumab [Internet]. 2021 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/publico/lista.html
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica tildrakizumab [Internet]. 2022 [citado 2022 dic 12]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1181323001/FT_1181323001.html#1-nombre-del-medicamento
- Armstrong AW, Gooderham M, Warren RB, Papp KA, Strober B, Thaçi D, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: efficacy and safety results from the 52-week, randomized, double-blinded, placebo-controlled phase 3 POETYK PSO-1 trial. J Am Acad Dermatol [Internet]. 2022 [citado 2022 dic 13]; Disponible en: https://pubmed.ncbi.nlm.nih.gov/35820547/
- Armstrong AW. Treatment selection for moderate to severe plaque psoriasis in special populations [Internet]. UpToDate. 2022 [citado 2022 dic 13]. Disponible en: https://www.uptodate.com/contents/treatment-selection-for-moderate-to-severe-plaque-psoriasis-in-special-populations
- Keltz Pomeranz M. Management of psoriasis in pregnancy [Internet]. UpToDate. 2022 [citado 2022 dic 14]. Disponible en: https://www.uptodate.com/contents/management-of-psoriasis-in-pregnancy
- Armstrong AW. Nail psoriasis [Internet]. UpToDate. 2022 [citado 2022 dic 14]. Disponible en: https://www.uptodate.com/contents/nail-psoriasis
- Tucker L, Allen A, Chandler D, Ciurtin C, Dick A, Foulkes A, et al. The 2022 British Society for Rheumatology guideline for the treatment of psoriatic arthritis with biologic and targeted synthetic DMARDs. Rheumatology (Oxford) [Internet]. 2022 [citado 2022 dic 14];61(9):e255-66. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35640657/
- Singh JA, Guyatt G, Ogdie A, Gladman DD, Deal C, Deodhar A, et al. Special Article: 2018 American College of Rheumatology/National Psoriasis Foundation Guideline for the Treatment of Psoriatic Arthritis. Arthritis and Rheumatology [Internet]. 2019 [citado 2022 dic 14];71(1):5-32. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/art.40726
- Sociedad Española de Reumatología. Guía de Práctica Clínica para el Tratamiento de la Espondiloartritis Axial y la Artritis Psoriásica [Internet]. Espoguía. 2018 [citado 2022 dic 14]. Disponible en: https://www.ser.es/wp-content/uploads/2016/03/ESPOGUIA-actualizaci%C3%B3n-2017_DEF_web.pdf
- Coates LC, Corp N, van der Windt DA, O’Sullivan D, Soriano ER, Kavanaugh A. GRAPPA Treatment Recommendations: 2021 Update. J Rheumatol [Internet]. 2022 [citado 2022 dic 14];49(6 Suppl 1):52-4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35293339/